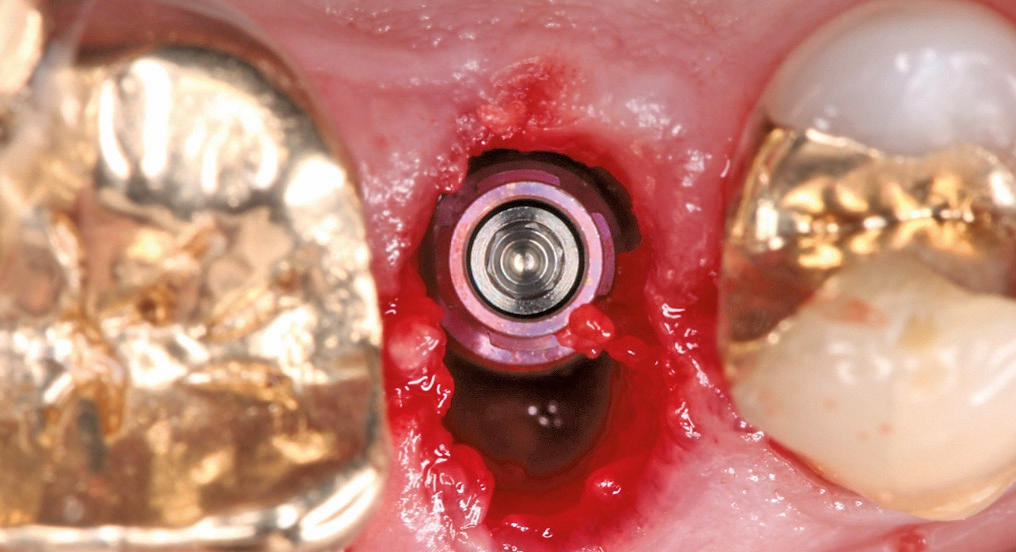
Periimplantäre Infektionen rücken immer stärker in den Fokus des zahnärztlichen Praxisalltags. Beim 6. European Workshop on Periodontology wurde bereits im Jahre 2008 beschrieben, dass Periimplantitiden in bis zu 56 % und periimplantäre Mukositiden bei bis zu 80 % der untersuchten Patienten auftreten [11]. Als primärer ätiologischer Faktor für die Entstehung periimplantärer Infektionen gilt die Anlagerung von Biofilmen an die Implantatoberfläche [14,16]. Direkt nach Kontakt mit dem oralen Milieu setzt die bakterielle Besiedelung der Implantatoberfläche ein [4]. Bereits wenige Wochen nach Implantatinsertion etabliert sich eine submukosale Bakterienflora, die vergleichbar zu jener einer Parodontitis ist [15,28]. Diese sich entwickelnden Biofilme können bei entsprechendem Missverhältnis zwischen Körperabwehr und bakterieller Besiedelung zu periimplantären Infektionen führen [26]. Im Fokus der kausalen Therapie von periimplantären Mukositiden und Periimplantitiden steht daher die Entfernung dieser Biofilme von den Implantatoberflächen [10,17]. Dieser Aspekt ist zentraler Bestandteil der Therapie periimplantärer Infektionen sowohl für nichtchirurgische Therapieansätze als auch im Rahmen von chirurgisch-korrektiven Verfahren, beispielsweise bei Dekontaminationen und Konditionierung der Implantatoberflächen vor regenerativen Eingriffen.
Konventionelle Instrumentierung und Ultraschall
Am häufigsten werden günstig verfügbare Küretten zur mechanischen Biofilmentfernung auf zahnärztlichen Implantaten eingesetzt – dabei ist die Effektivität dieser Instrumente begrenzt. Unter Laborbedingungen wurden bei der Biofilmentfernung mittels Plastikküretten Werte zwischen 31,5 % und 61 % Restbiofilmanteil beschrieben [6,24]. Auch unter Zusatz von Chlorhexidindigluconat konnten diese Ergebnisse nicht verbessert werden. Oberflächenartefakte konnten nach Behandlung mit Plastikküretten nicht festgestellt werden [3,15]. Metallscaler sind bezüglich der Effektivität bei der Biofilmentfernung den Plastikküretten leicht überlegen. Nach ihrer Anwendung wurden Restbiofilmanteile von 29 % nachgewiesen. Allerdings wurden in den gleichen Untersuchungen deutliche Kratzartefakte, bis hin zur völligen Zerstörung der Implantatoberfläche, auf den rauen SLA-Oberflächen festgestellt [8].
Ultraschallsysteme sind ebenso weit verbreitet, allerdings sind auch sie mit einem Restbiofilmanteil von etwa 37 % auf rauen Implantatoberflächen nicht ausreichend effektiv [24]. Der Einsatz von ultraschallbetriebenen Stahlspitzen erzeugt sehr starke Kratzartefakte auf den Implantatoberflächen. Dies ist, in abgeschwächter Form, auch der Fall bei Einsatz von Karbon- oder Plastikspitzen auf maschinierten Titanimplantat- und Titanabutmentoberflächen [5,23].
Lasersysteme, insbesondere der Erbium-doped:Yttrium, Aluminium und Garnet-Laser (Er:YAG-Laser), sind deutlich effektiver als oben genannte Methoden. Mit diesen Geräten konnte intraoral gesammelter Biofilm auf bis zu 9,8 % [29] beziehungsweise 5,8 % [24] reduziert werden. Eine in der Anschaffung deutlich kostengünstigere, aber ebenso effektive Variante zur Dekontamination von Implantatoberflächen stellen Pulverstrahlgeräte dar. Im Nachfolgenden soll ein kleiner Überblick über Untersuchungen zu Dekontaminationen mittels Pulverstrahlen an zahnärztlichen Implantaten gegeben werden.
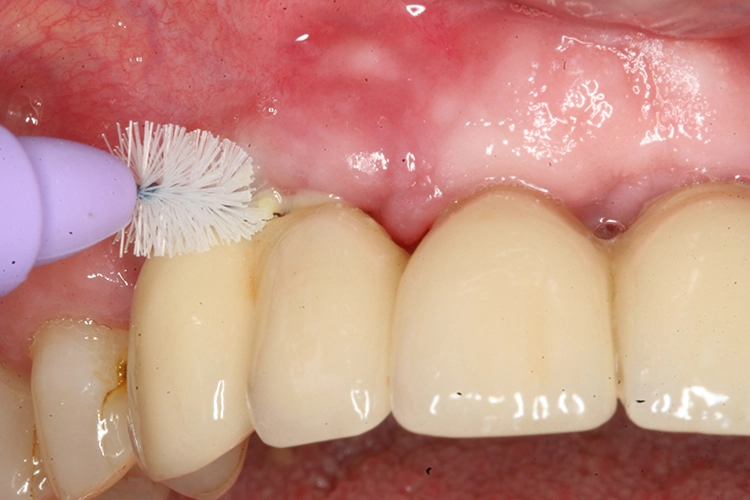
In-vitro-Untersuchungen: Vorteile für das Pulverstrahlen
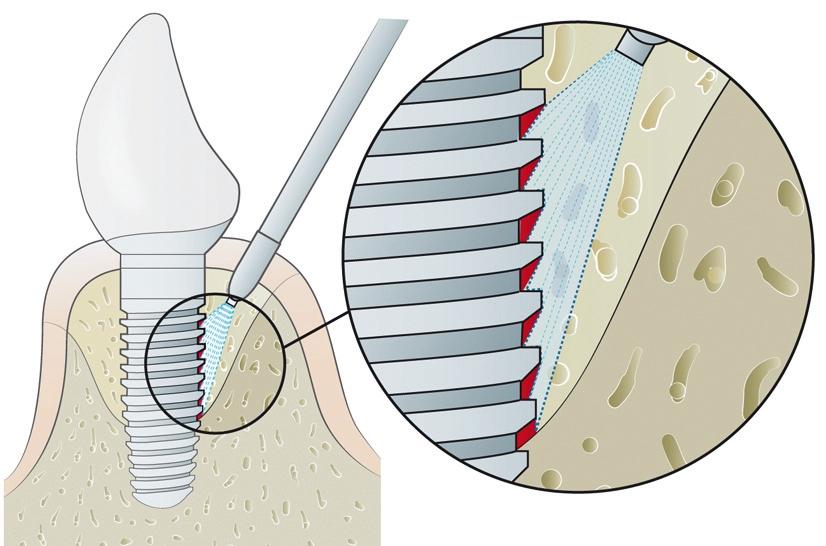
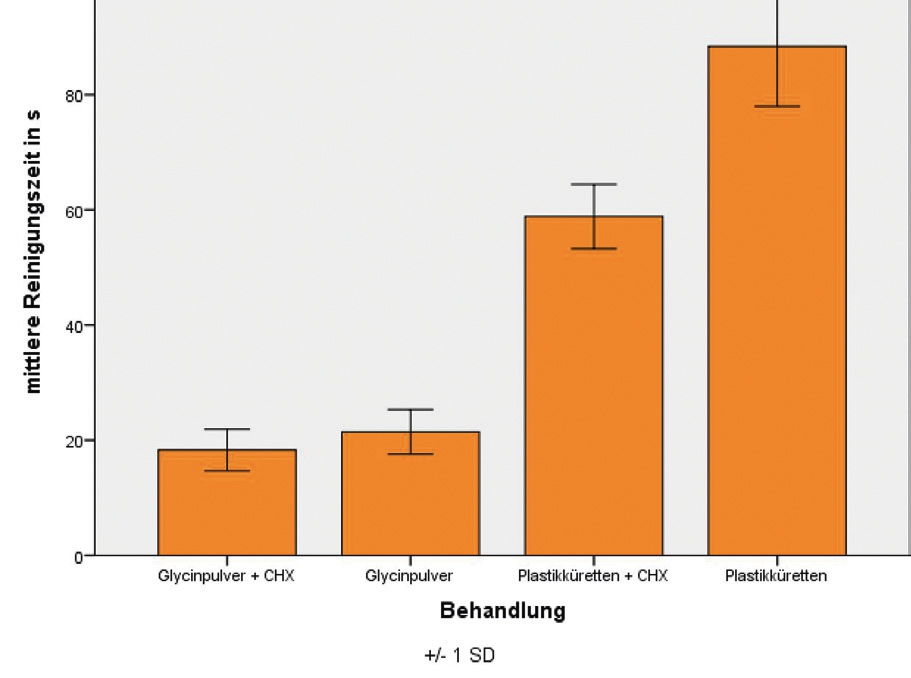
In anderen Untersuchungen [6], die unter optimierten Laborbedingungen ohne Defektsimulation – allerdings an in vivo gesammelten, initialen Biofilmen – durchgeführt wurden, konnten nach Glycinpulverstrahlen 98,9 % dekontaminierte, vom Biofilm befreite Implantatoberfläche nachgewiesen werden; im Vergleich: Mittels Plastikküretten konnte 68,5 % der Implantatoberfläche dekontaminiert werden. In dieser Studie wurde die Dekontamination so lange durchgeführt, bis makroskopisch kein Biofilm mehr entfernt werden konnte. Die Behandlungsdauer wurde dabei als ein Parameter erfasst: Für die Glycinpulverstrahlung wurde eine mittlere Behandlungszeit von 21,5 Sekunden beobachtet. Dem stehen 88,4 Sekunden Anwendungsdauer mit Plastikküretten gegenüber [6]. In dieser Studie konnte nicht nur die signifikant höhere Effektivität von Glycinpulverstrahlung gegenüber Plastikküretten gezeigt werden, sondern auch eine signifikant höhere Effizienz, was gerade im Praxisalltag wichtig ist, da eine verkürzte Behandlungsdauer ein Faktor für eine bessere Akzeptanz bei den Patienten ist und ebenso einen wirtschaftlichen Faktor darstellt (Abb. 2a u. b).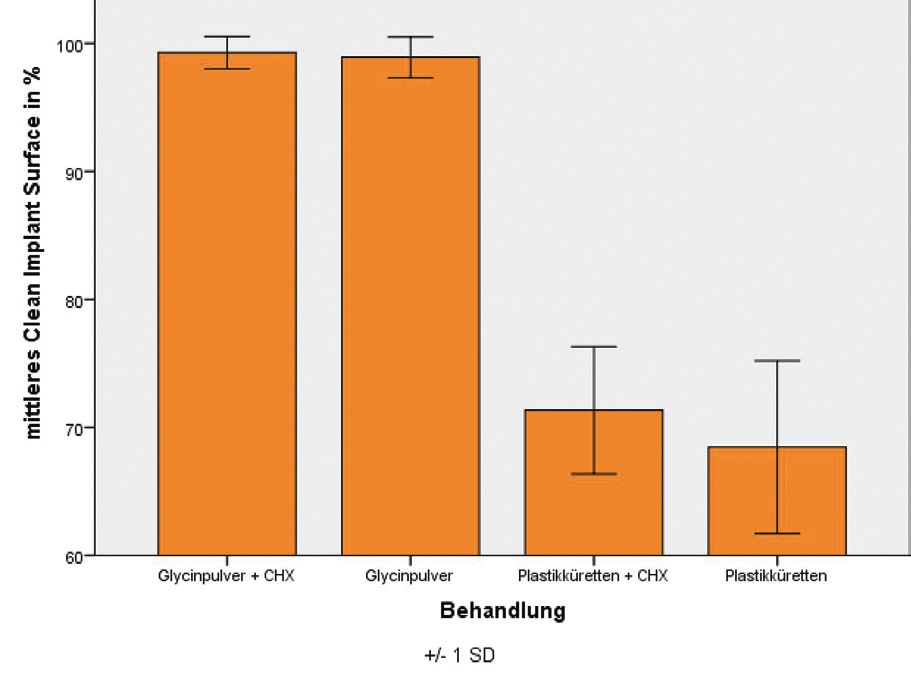
Mit welchem Pulver strahlen?
In ähnlichen Untersuchungen wurden Glycinpulver mit Natriumbicarbonatpulvern verglichen [25]. Auch diese Studien wurden an in vivo gesammelten, natürlichen, initialen Biofilmen durchgeführt. Bezüglich der Effektivität nach einmaliger Pulverstrahlung wurden Restbiofilmanteile von 0 % bis 5,7 % bei drei verschiedenen Glycinpulvern beobachtet, während nach einmaliger Applikation von Natriumbicarbonatpulver ein Restbiofilmanteil von 0 % bis 0,4 % festgestellt wurde. Nach zweimaliger Applikation war bei allen Pulvern in dieser Studie kein Restbiofilmanteil mehr vorhanden. In diesen Untersuchungen wurden rasterelektronenmikroskopische Aufnahmen nach den Dekontaminationen durchgeführt, um die Implantatoberflächen nach der Biofilmentfernung beurteilen zu können. Hierbei wurden nach einmaliger Anwendung sämtlicher untersuchter Pulver keine Oberflächenveränderungen festgestellt. Nach zweimaliger Pulverstrahlung zeigten sich in der Natriumbicarbonatgruppe Oberflächenartefakte in Form von Abflachungen der typischen scharfen Ränder und Spitzen der säuregeätzten und sandgestrahlten Titanimplantatoberflächen, während in den Glycinpulvergruppen keine Oberflächenveränderungen festgestellt wurden [25].
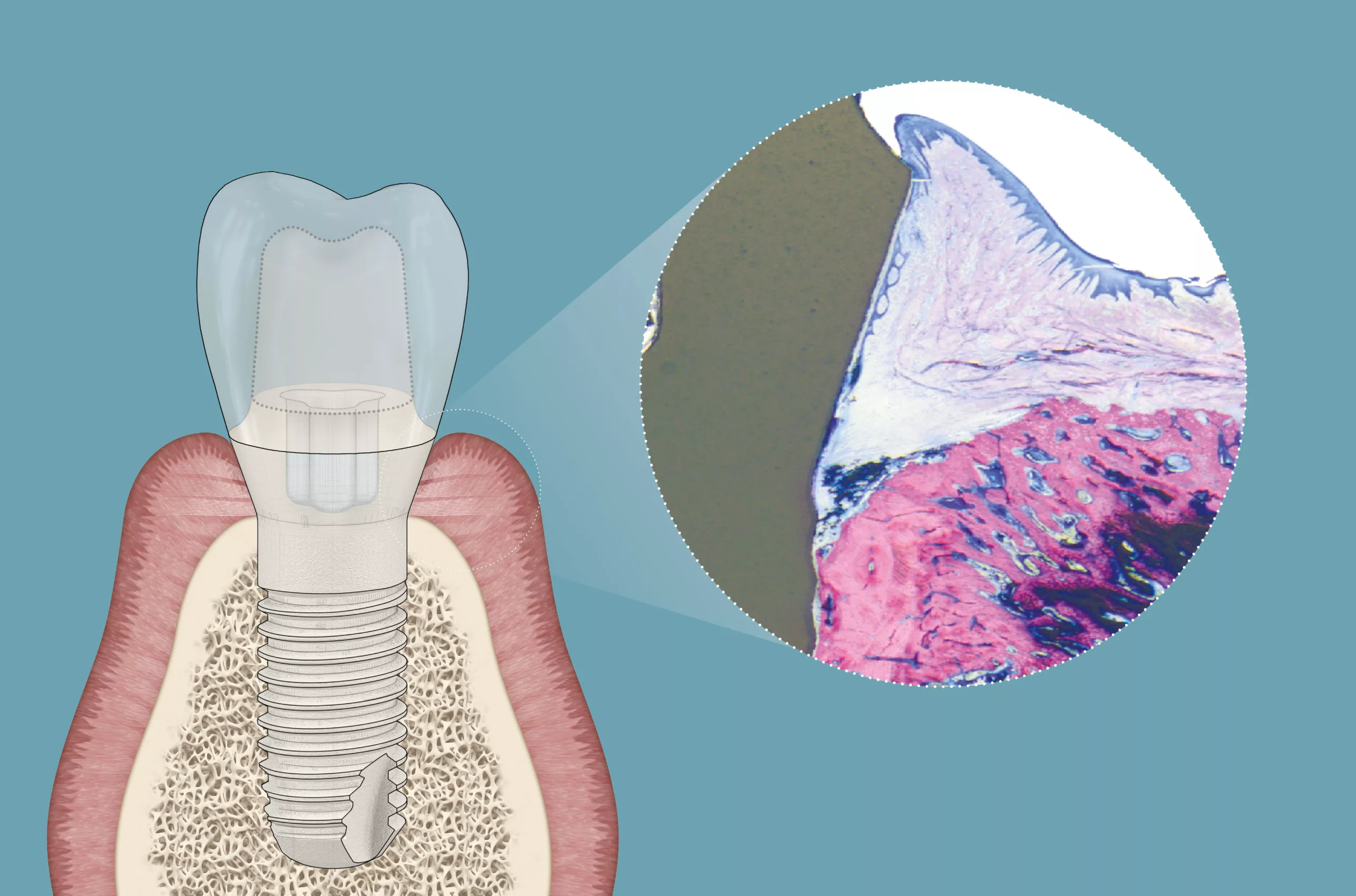
Die Pulver können in ihrer Zusammensetzung beliebig variiert werden, sodass es naheliegt, auch Modifikationen von Pulvern zu untersuchen. So wurde beispielsweise die Effektivität eines Gemisches aus Glycin und Tricalciumphosphat (TCP) zur Dekontamination von intraoral mit initialem Biofilm besiedelten Titanimplantaten untersucht und mit einem Glycinpulver sowie einem Natriumbicarbonatpulver verglichen [7]. Bezüglich der Effektivität war das Glycin-TCP-Gemisch mit 0,1 % Restbiofilmanteil auf säuregeätzten und sandgestrahlten Titanimplantatoberflächen (SLA-Oberflächen) dem klassischen Glycinpulver mit 0,44 % sowie dem Natriumbicarbonatpulver mit 1,51 % signifikant überlegen. Bezüglich der benötigten Anwendungszeit – bis makroskopisch kein Biofilm mehr beseitigt werden konnte – ergaben sich keine signifikanten Unterschiede zwischen den Gruppen. Die Effizienz der verglichenen Pulver war also ähnlich. Die rasterelektronenmikroskopischen Untersuchungen nach den Dekontaminationsprozessen zeigten in allen drei Gruppen spärliche und minimale Abflachungen sowie Abrundungen des Oberflächenreliefs (Abb. 3 a–c).

In der gleichen Studie wurden diese drei Pulver ebenfalls auf Zirkonoxidoberflächen untersucht. Bezüglich der Effektivität bei der Biofilmentfernung ergab sich folgende Reihenfolge: Das Glycin-TCP wies mit 0,01 % den geringsten Restbiofilmanteil auf, gefolgt vom Natriumbicarbonatpulver mit 0,14 % sowie dem Glycinpulver mit 0,24 %. Diese Unterschiede waren nicht signifikant, deuteten jedoch auch in der Tendenz auf das Glycin-TCP als effektivstes Pulver hin. Die benötigte Applikationszeit, um diese Ergebnisse zu erreichen, war in der Glycin-TCP-Gruppe signifikant geringer als in den beiden Vergleichsgruppen. Nach der Oberflächenbehandlung konnten mit keinem der drei verwendeten Pulver Oberflächenartefakte auf den Zirkonoxidoberflächen festgestellt werden [7] (Abb. 4 a–c). Trotz der vielversprechenden Ergebnisse ist dieses Pulvergemisch nicht mehr am Markt erhältlich. Aufgrund technischer Komplikationen, die in der Kombination mit lediglich einem Pulverstrahlgerät auftraten, wurde der Vertrieb dieses Pulvergemisches eingestellt. Allerdings bleibt hervorzuheben, dass keinerlei Komplikationen an den Implantaten auftraten oder biologische Komplikationen an den Patienten nachzuweisen waren.
Positive klinische Studienergebnisse für Glycin
Die vielversprechenden präklinischen Ergebnisse, die mittels Pulverstrahlsystemen erreicht wurden, konnten insbesondere für Glycinpulver auch in klinischen Studien bestätigt werden. Im Rahmen nichtchirurgischer Periimplantitistherapien führte eine einmalige Dekontamination von Implantaten mittels Glycinpulverstrahlung in einem Nachbeobachtungsrahmen von 3 beziehungsweise 6 Monaten zu einem signifikant verringerten Bleeding on Probing (BOP) im Vergleich zu einer einmaligen Dekontamination mittels Plastikküretten in Kombination mit einer zusätzlichen antiseptischen Therapie in Form von Chlorhexidindigluconat-Applikation [19]. Sogar in einem Nachbeobachtungsintervall von bis zu 12 Monaten konnten nach einmaliger Glycinpulverstrahlung im Vergleich zur einmaligen mechanischen Implantatdekontamination mittels Plastikküretten und adjuvanter Chlorhexidindigluconat- Applikation ein signifikant geringerer BOP festgestellt werden [9]. In einer weiteren klinischen Studie konnten beim Vergleich von einmaliger Glycinpulverstrahlung und Implantatdekontamination mittels Er:YAG-Laser vergleichbare Ergebnisse bezüglich der Reduktion der Taschentiefen, des BOP sowie Verringerung der Suppuration in einem Nachbeobachtungszeitraum von 6 Monaten festgestellt werden [13]. Diese positiven Resultate, insbesondere die guten klinischen Ergebnisse, führten dazu, dass in der aktuellen S3-Leitlinie „Die Behandlung periimplantärer Infektionen an Zahnimplantaten“ das Glycinpulverstrahlen neben dem Einsatz von Er:YAG-Lasern, der photodynamischen Therapie, dem adjuvanten Einsatz lokaler Antibiotika sowie Chlorhexidindigluconat-Chips aufgrund der guten Evidenzlage zur Implantatdekontamination im Rahmen der nichtchirurgischen Periimplantitistherapie empfohlen wird [22].
Ein weiterer interessanter Ansatz könnte die Verwendung von Erythritolpulver sein. Hierzu gibt es bereits In-vitro-Untersuchungen, die die Effektivität bezüglich der Biofilmentfernung von rauen Titanimplantatoberflächen bestätigten [2,12]. Allerdings liegen noch keine klinischen Vergleichsstudien zu diesem Therapieansatz vor, sodass aufgrund der geringen Evidenz diese Methode noch nicht für den Praxisalltag zu diesem Zeitpunkt empfohlen werden kann. Trotz der guten Ergebnisse, der hohen Effektivität bezüglich der Biofilmentfernung sowohl auf Titanimplantatoberflächen als auch auf Zirkonoxidimplantatoberflächen sowie der hohen Effizienz muss darauf hingewiesen werden, dass bei der Anwendung von Pulverstrahlgeräten auch bei der Periimplantitistherapie die Gefahr der Ausbildung von Emphysemen besteht [1,27].
Fazit
Die Dekontamination von zahnärztlichen Implantaten mittels Pulverstrahlen ist effektiv und effizient. Dies konnte in Studien belegt werden. Weiterhin wurde nachgewiesen, dass Pulverstrahlen eine schonende Behandlungsmethode sowohl auf Titanimplantaten als auch auf Zirkonoxidimplantaten ist. Dies gilt insbesondere für die Glycinpulverstrahlung, bei der lediglich minimale Abrundungen des Oberflächenreliefs auf säuregeätzten und sandgestrahlten Titanimplantaten bis gar keine Oberflächenartefakte nachzuweisen waren. Auch klinische Studien konnten diese guten Ergebnisse bestätigen und einen Behandlungserfolg nach Implantatdekontamination mittels Glycinpulverstrahlung im Rahmen der nichtchirurgischen Periimplantitistherapie in einem Nachbeobachtungszeitraum von bis zu 12 Monaten nachweisen. Aufgrund dieser guten Ergebnisse und der hohen Evidenzlage wird die Glycinpulverstrahlung in der aktuellen Leitlinie „Die Behandlung periimplantärer Infektionen an Zahnimplantaten“ im Rahmen der nichtchirurgischen Periimplantitistherapie empfohlen.
Bildquellen sofern nicht anders deklariert: Unternehmen, Quelle oder Autor/-in des Artikels
 Entdecke CME Artikel
Entdecke CME Artikel  Entdecke Artikel mit Download
Entdecke Artikel mit Download 



 Mit Google einloggen
Mit Google einloggen
 Mit Facebook einloggen
Mit Facebook einloggen
Keine Kommentare.