Langzeiterfahrungen haben inzwischen die Wichtigkeit der kontinuierlichen Vorsorge und rechtzeitigen Weiterbehandlung von Implantaten klargestellt. Zu nennen ist vor allem die Periimplantitis. Statistiken zu Folge müssen jährlich rund 100.000 Implantate aufgrund von Periimplantitis wieder entfernt werden. Diese Implantat-assoziierte Erkrankung kann einerseits als Folge der nicht optimal verlaufenden Erstbehandlung auftreten, anderseits auf einer bakteriellen Entzündung, z. B. bei fortgeschrittenen parodontalen Erkrankungen oder vernachlässigter Mundhygiene beruhen [4]. Ihr Fortschreiten führt zum Abbau des Knochen- und Weichgewebes und somit zum Verlust des Implantats. Kieferatrophie kann infolge von unterschiedlichen Erkrankungen auftreten, die alle zum Zahnverlust führen [5]. Um den Kiefer wiederherzustellen stehen heute viele etablierte Methoden zur Verfügung. Diese können entweder auf dem patienteneigenen Knochen im Sinne der autologen Transplantation zurückgreifen oder auf nicht autologe Knochenersatzmaterialien [6]. Viele Knochenersatzmaterialien unterschiedlicher Herkunft sind auf dem europäischen Markt verfügbar. Allerdings müssen diese Biomaterialien von zellulären Komponenten befreit werden, um eine mögliche Allo- bzw. Xeno-Immunreaktion zu vermeiden [7]. Deshalb können diese Materialien bestenfalls als eine Leitstruktur betrachtet werden, die eine sehr wichtige Rolle spielt, um die Regeneration des ortständigen Knochens zu unterstützen.
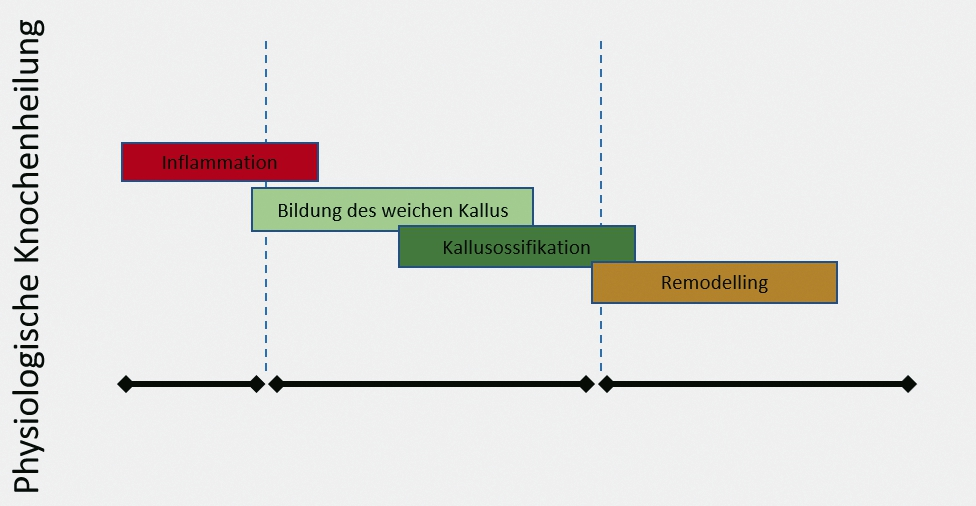 Dr. Torsten Conrad
Dr. Torsten Conrad
Da die autologen biologischen Komponenten des Patienten für die Regeneration essentiell sind, diese aber in den meisten Fällen aufgrund der Defektmorphologie nicht ausreichen, werden in der minimalinvasiven Oral- und Kieferchirurgie Knochenersatzmaterialien mit eigenen Knochenspänen gemischt, um das Ausmaß an transplantiertem Knochengewebe zu minimieren und gleichzeitig die azellulären und avaskulären Knochenersatzmaterialien mit autologen und biologischen Komponenten zu impfen [10]. Diese Maßnahme soll die Integration des Knochenersatzmaterials im Defekt und dessen Regeneration beschleunigen. Allerdings ist diese Maßnahme weiterhin mit einer autologen Knochenentnahme verbunden, die aber meistens ohne zweite Wunde erfolgen kann.
Eine weitere autologe Alternative bieten Blutkonzentrate, die aus dem patienteneigenen peripheren Blut gewonnen werden. Vor allem das Plättchen-reiche Fibrin (PRF) bietet viele Vorteile aufgrund seiner besonderen Zusammensetzung und seiner einfachen Herstellung ohne externe Zusätze wie Antikoagulantien [11].
Herstellung des Plättchen-reichen Fibrins (PRF)
Das PRF wird aus dem patienteneigenen peripheren Blut hergestellt. Die Blutentnahme erfolgt meistens an der medianen Armvene. Dabei wird das periphere Blut in den entsprechenden, nicht antikoagulierenden Entnahmeröhrchen aufgenommen. Jedes Röhrchen hat ein Volumen von 10 ml und muss vollständig gefüllt werden, um eine erfolgreiche Zentrifugation durchführen zu können. Das PRF kann in zwei unterschiedlichen Formen hergestellt werden: die solide PRF-Matrix und die flüssige PRF-Matrix [12]. Je nachdem, welche PRF-Form gebraucht wird, muss ein anderes Entnahmeröhrchen verwendet werden. Für das solide PRF werden Entnahmeröhrchen mit Glasoberfläche verwendet, um die Koagulation zu unterstützen und direkt nach der Zentrifugation eine solide PRF-Matrix zu erhalten. Für das flüssige PRF werden Entnahmeröhrchen mit Plastikoberfläche verwendet, um die physiologische Koagulation ohne eine Verwendung von Antikoagulantien zu verlangsamen. Nach der Entnahme werden die Röhrchen unverzüglich zentrifugiert. Durch die Zentrifugation werden die Blutbestandteile getrennt und konzentriert. Die obere Phase bildet das PRF, welches aus Fibrin, Thrombozyten, Leukozyten, Plasmaproteinen und Wachstumsfaktoren besteht. In der unteren Phase sammeln sich hauptsächlich die Erythrozyten. Nach der Zentrifugation entsteht also ein Konzentrat aus den wichtigsten Blutbestandteilen, die für die Regeneration eine sehr essentielle Rolle spielen. Allerdings hängt die Zusammensetzung des PRFs stark von der angewendeten Zentrifugalkraft ab [13].
Das Low Speed Centrifugation Concept (LSCC)
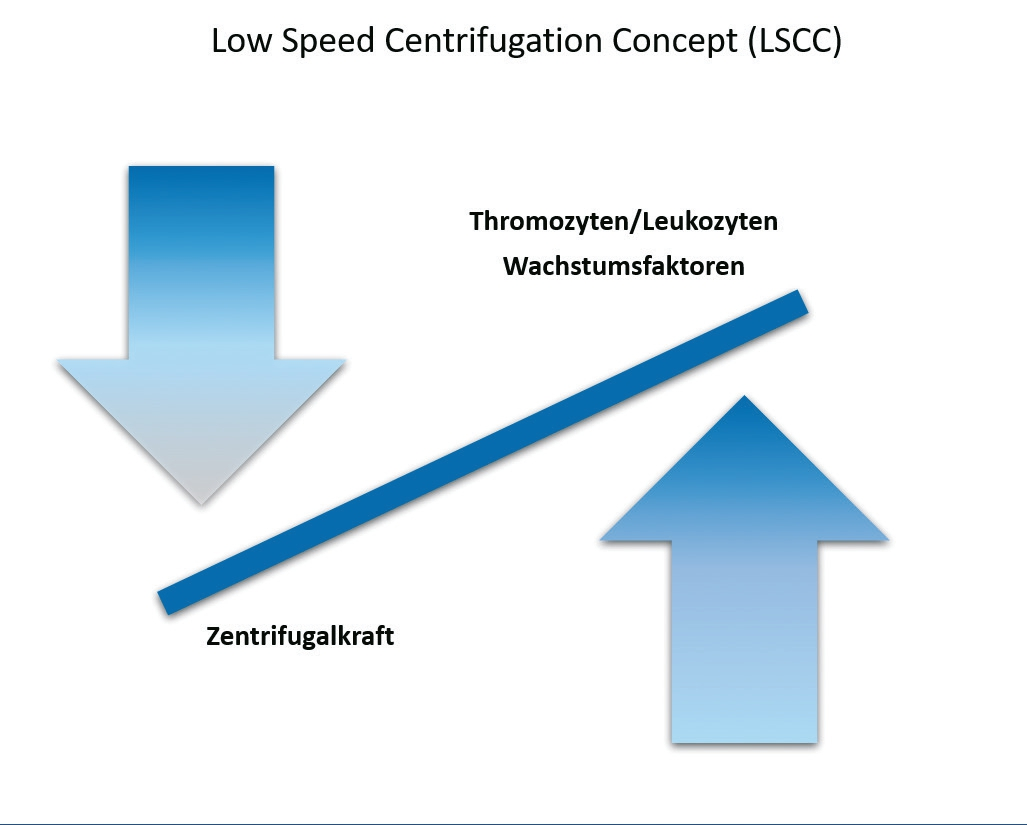 Dr. Torsten Conrad
Dr. Torsten Conrad
PRF ist in der Lage viele Wachstumsfaktoren freizusetzen, die für die Regeneration essenziell sind [19]. Zu nennen sind VEGF, welcher bei der Angiogenese eine Schlüsselrolle übernimmt [19,20]. PDGF wird ebenfalls in hohen Konzentrationen freigesetzt. Dieser Wachstumsfaktor wird von den Thrombozyten im Rahmen ihrer Aggregation sezerniert und ist in der initialen Phase der Regeneration sowohl im Weichgewebe als auch im Knochengewebe maßgeblich beteiligt [21,22]. EGF ist besonders wichtig für die Gefäßneubildung und die Epithelialisierung und kann somit zur Beschleunigung des Wundverschlusses beitragen [23,24]. Die Besonderheit an den Blutkonzentraten besteht in der autologen Quelle der angereicherten Zellen und Wachstumsfaktoren.
Kombination von PRF mit Knochenersatzmaterialien und kollagenbasierten Membranen
Biomaterialien werden aus unterschiedlichen Quellen gewonnen (allogen, xenogen, phykogen, synthetisch). Alle haben gemeinsam, dass sie keine lebenden Zellen enthalten dürfen und deshalb vor allem als eine Leitstruktur dienen sollen. Die Biologisierung der Biomaterialien mit autologen Knochenspänen ist eine etablierte Methode. Dabei soll vor allem bei größeren Defektmorphologien die Regeneration beschleunigt werden. PRF bietet eine minimalinvasive autologe Alternative, um passive Biomaterialien mit patienteneigenen Regenerationsfaktoren zu aktivieren. Dabei können sowohl das flüssige als auch das feste PRF für die Aktivierung und Biologisierung von Biomaterialien verwendet werden. Knochenersatzmaterialien werden mit kleingeschnittener solider PRF-Matrix gemischt und mit der flüssigen PRF-Matrix zusätzlich aktiviert. Sobald das flüssige PRF koaguliert, entsteht eine klebrige modulierbare Masse, bestehend aus PRF und Knochenersatzmaterialien. Diese kann dann in den Knochendefekt eingebracht werden und genau auf die gewünschte Form und Dimension moduliert werden. Die Kombination von PRF mit granulären Knochenersatzmaterialien erleichtert somit das Handling und die klinische Anwendbarkeit der Materialien und führt letztendlich zu verkürzten Operationszeiten. Darüber hinaus werden durch die Beladung mit den in PRF enthaltenen Blutzellen und den freigesetzten Wachstumsfaktoren dem Körper die nötigen Zellen zur Verfügung gestellt, die physiologisch während der Inflammationsphase erst rekrutiert werden müssen. Durch Zell-Zell-Kommunikation wandern dann ortständige Knochenzellen in das aktive Biomaterial hinein und führen zur Regeneration und Ossifikation des Defektes. Für die Aktivierung von kollagenbasierten Membranen und Matrizes eignet sich eher das flüssige PRF. Es wird in flüssiger Form auf die Membran appliziert und von ihr aufgenommen. Nach kurzer Zeit koaguliert das flüssige PRF in die Membran und erhöht durch das Fibringerüst seine Stabilität und Bioaktivität. Dadurch können kollagenbasierte Biomaterialien leichter an den Defekt adaptiert und angenäht werden.
Fallbeispiel
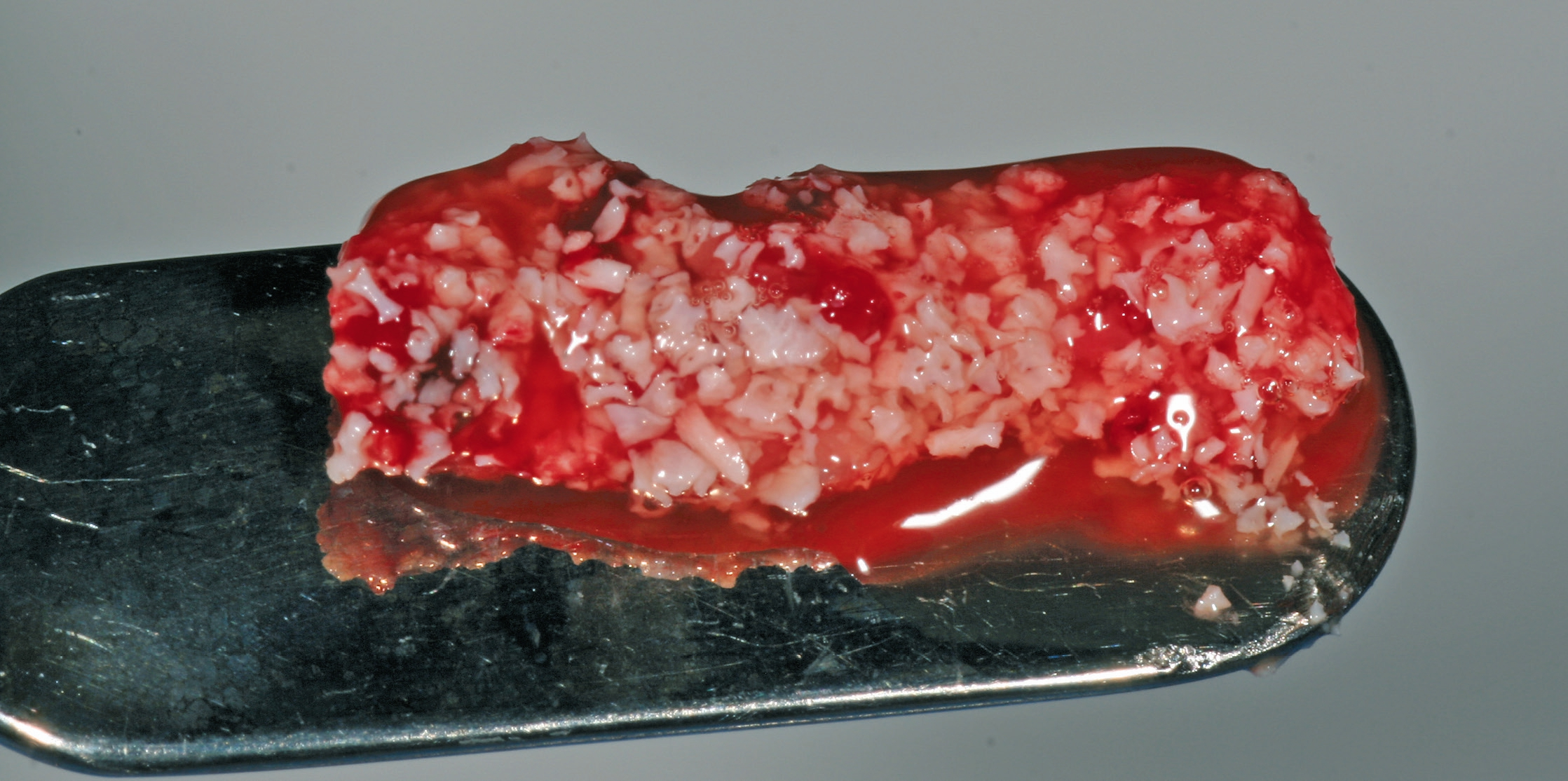
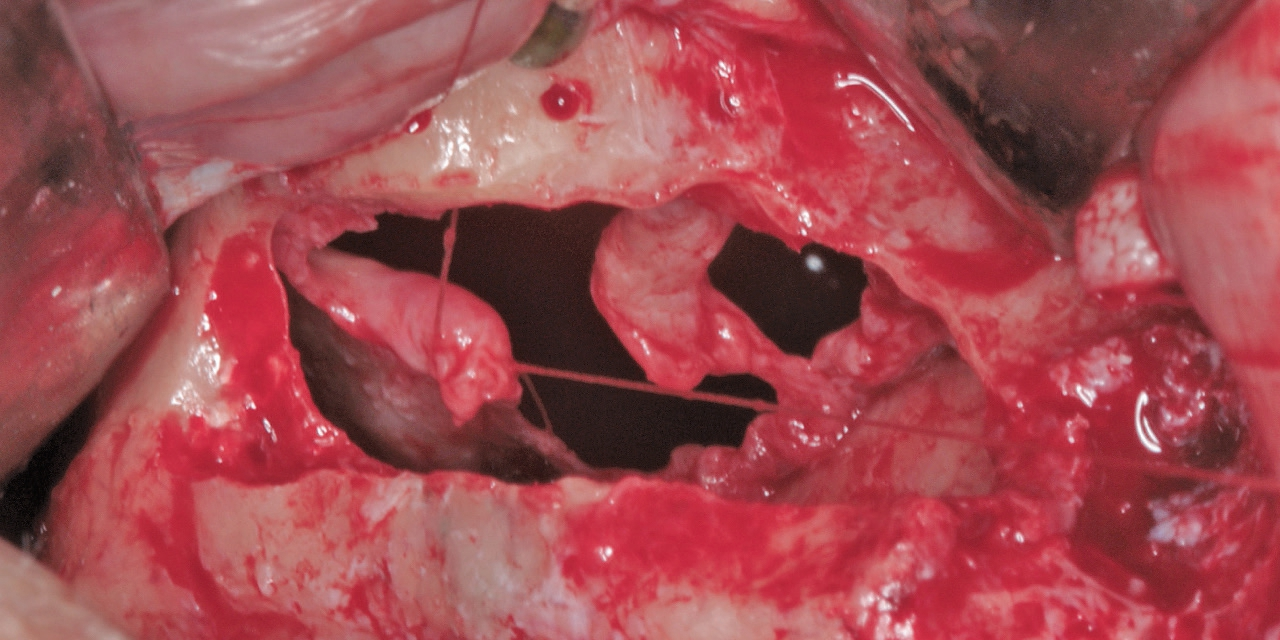
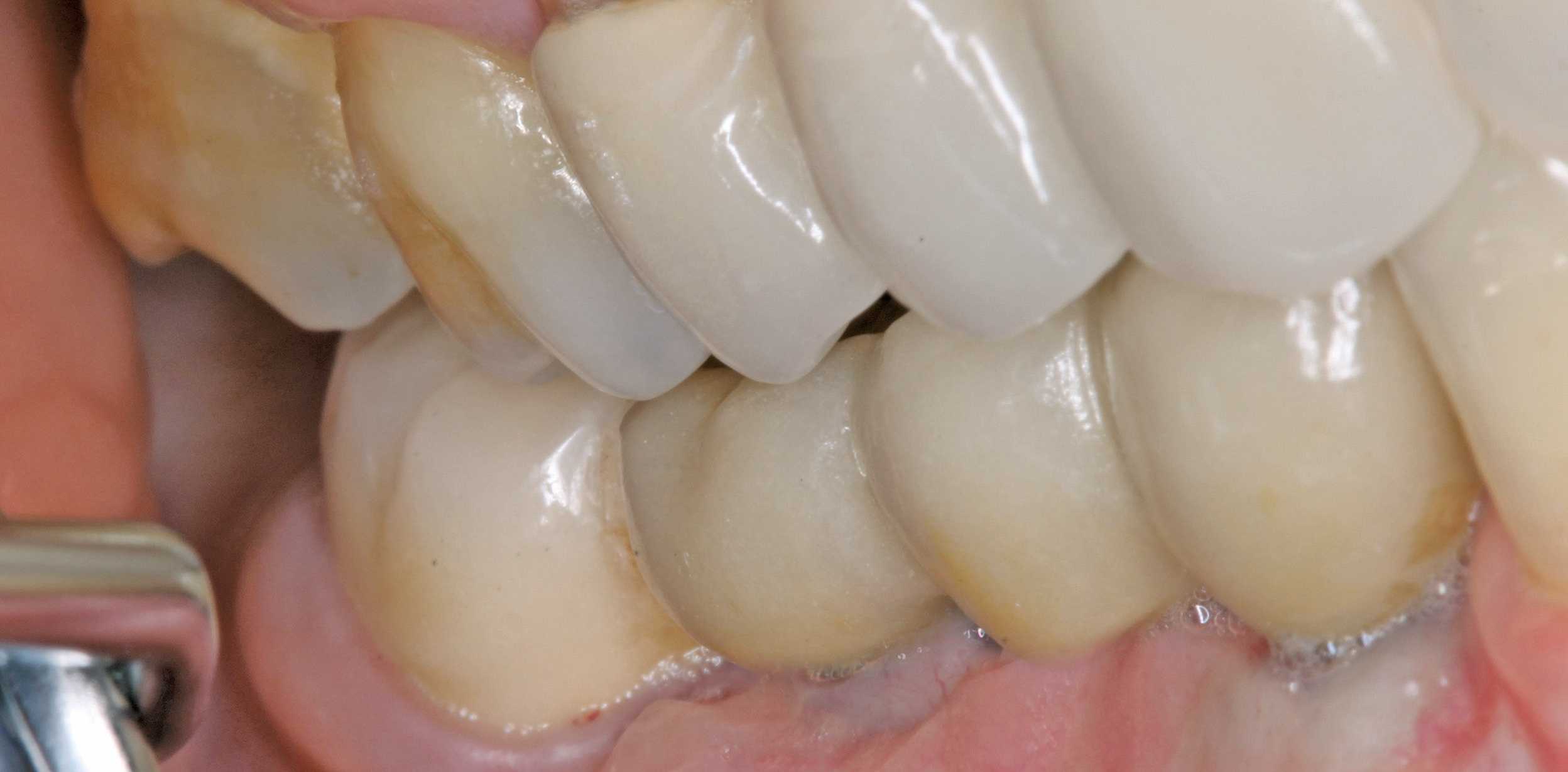
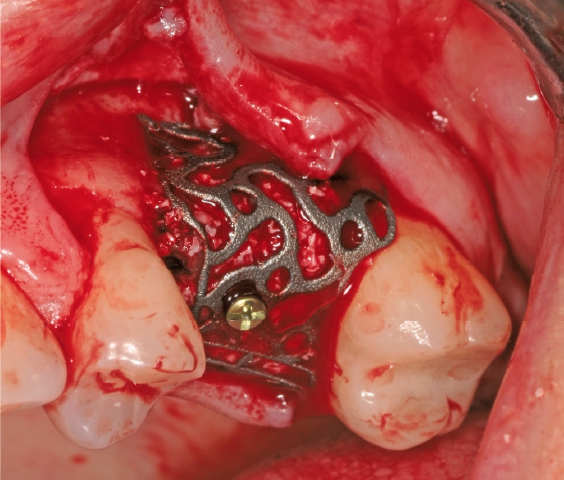
Eine ansonsten gesunde 66-jährige Patientin mit atrophem Oberkiefer nach Implantatverlust aufgrund von Periimplantitis in regio 15 stellte sich mit dem Wunsch auf Implantatversorgung in regio 16 vor (Abb. 3). Nach Aufklärung und Planung wurde ein externer Sinuslift mit simultaner Implantation vorgenommen. Nach der Präparation eines mukoperiostalen Lappens wurde das Fenster mittels Piezochirurgie präpariert und die Schneider‘sche Membran schonend gehoben, ohne eine Ruptur zu verursachen (Abb. 4 und 5). PRF wurde gemäß des LSCCs hergestellt. Dabei wurde der Patientin 40 ml Blut abgenommen (zwei Röhrchen flüssiges PRF und zwei Röhrchen festes PRF). Alle vier Röhrchen wurden gleichzeitig in die Zentrifuge beladen und mit 1200 Umdrehungen pro Minute für acht Minuten zentrifugiert (Duo Centrifuge, Process for PRF/Mectron). Die gleichzeitige Zentrifugation ermöglicht die Herstellung von flüssigen und festen PRF-Matrizen in einem Schritt. Dabei muss darauf geachtet werden, dass zwei unterschiedliche Röhrchentypen verwendet werden, nämlich einmal für das flüssige PRF und einmal für das feste PRF (Abb. 6). Das feste PRF wurde zunächst gepresst und dann kleingeschnitten und mit dem Knochenersatzmaterial (Geistlich Bio-Oss®; Geistlich Biomaterials, Baden-Baden) gemischt. Danach wurde das flüssige PRF appliziert und eine Koagulation des Knochenersatzmaterial- PRF-Gemisches abgewartet (Abb. 7-10). Die entstandene Masse wurde dann in den vorpräparierten Sinus eingebracht (Abb. 11). Darauffolgend erfolgte die Implantatinsertion in regio 26 (Camlog® Promote® plus) (Abb. 12). Das restliche Knochenersatzmaterial wurde für eine zusätzliche Augmentation verwendet. Der Defekt wurde dann mit einer mit flüssigem PRF aktivierten dreidimensionalen Kollagenmatrix (Mucograft®, Geistlich Biomaterials) gedeckt (Abb. 13). Der präparierte Lappen wurde adaptiert und speicheldicht mit Einzelknopfnähten verschlossen (Abb. 14). Nach einer Einheilungsphase und Freilegung wurde das Implantat nach sechs Monaten mit der entsprechenden Prothetik versorgt (Abb. 15 und 16).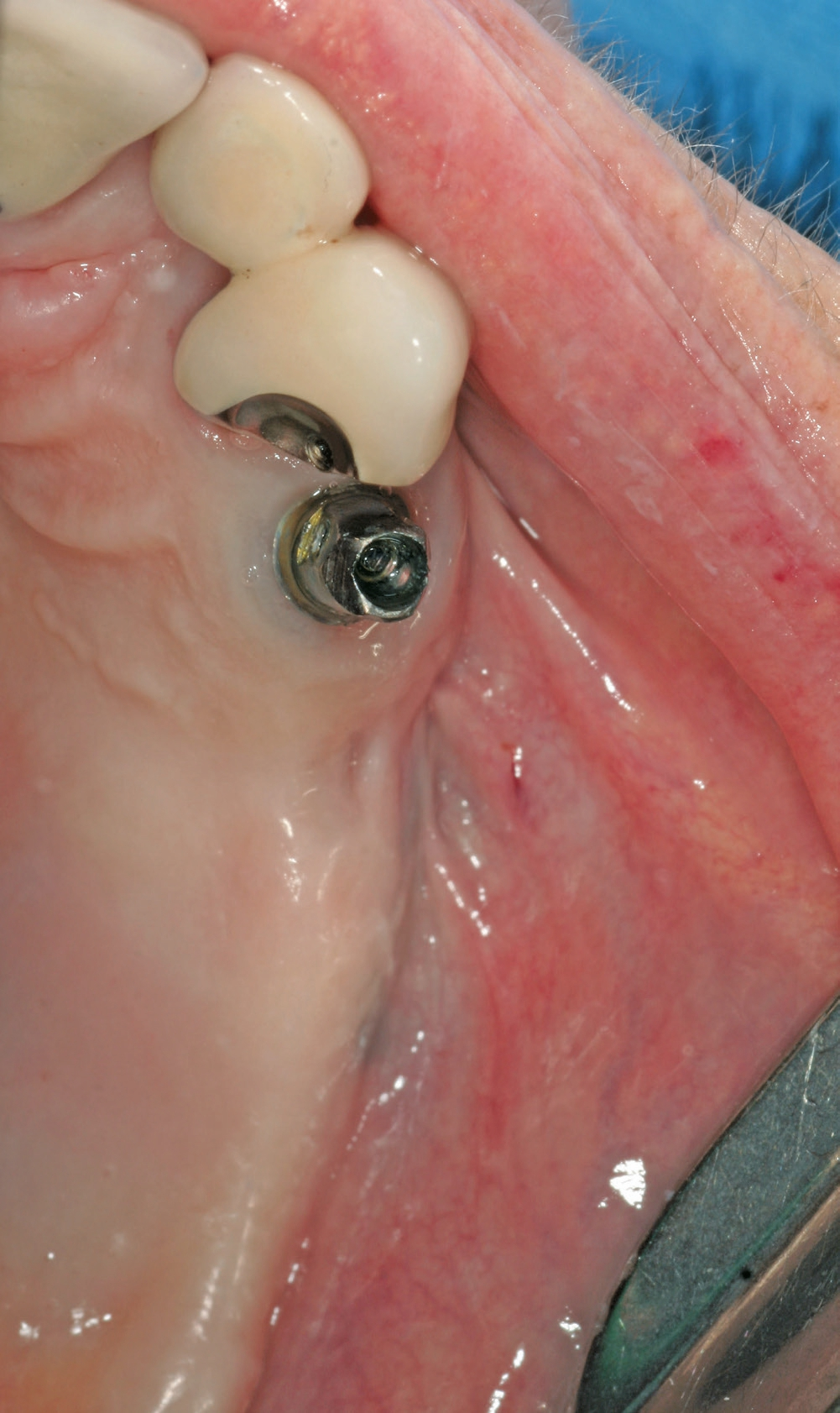 Dr. Torsten Conrad
Dr. Torsten Conrad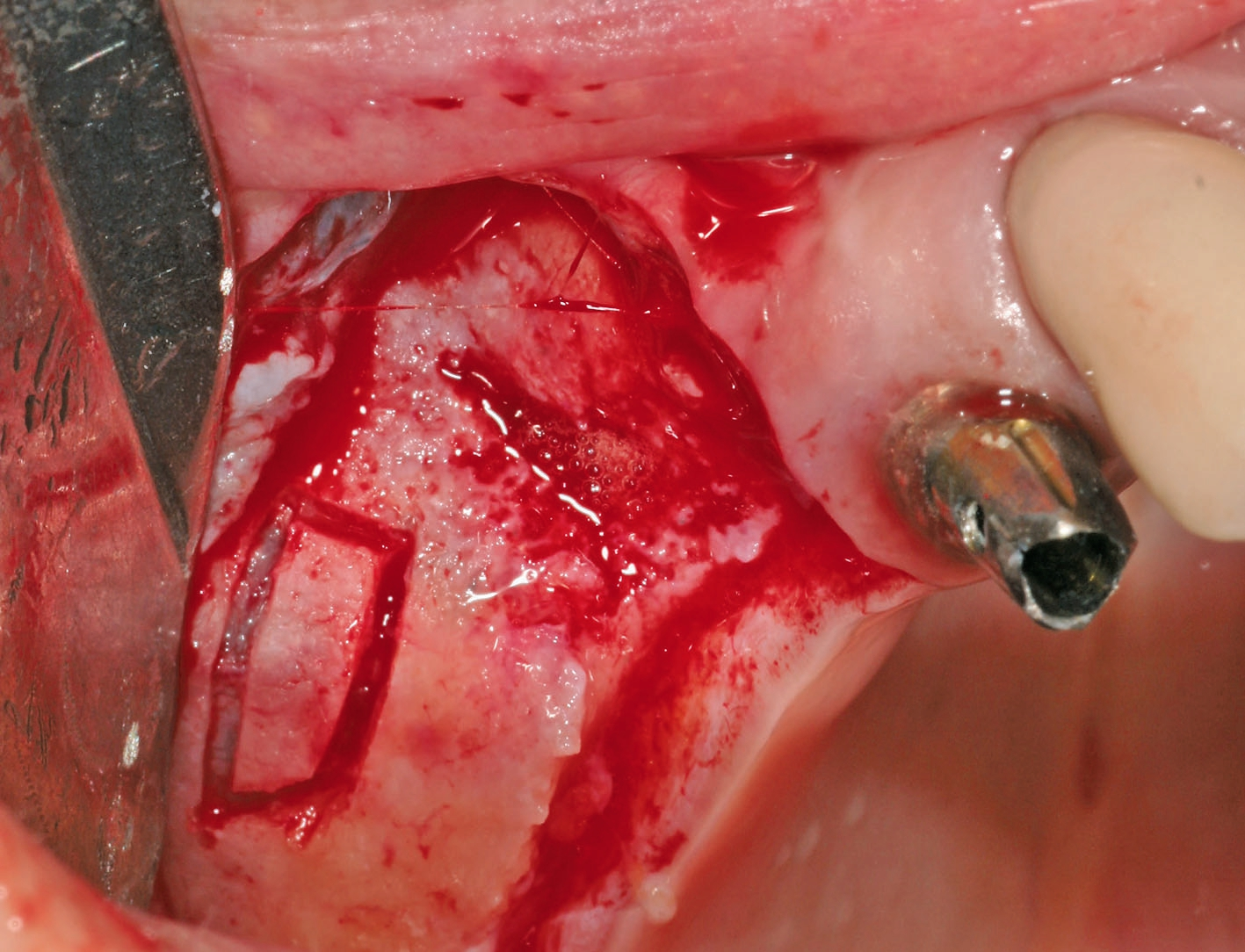 Dr. Torsten Conrad
Dr. Torsten Conrad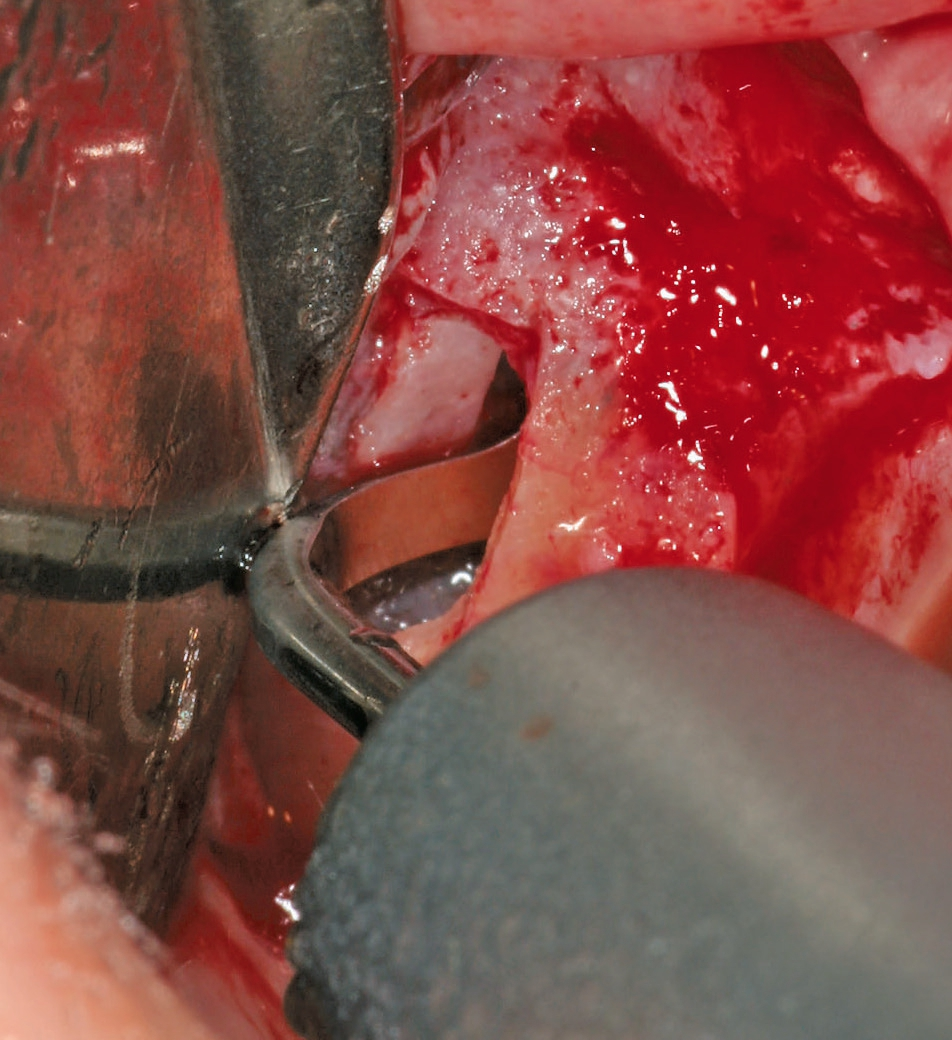 Dr. Torsten Conrad
Dr. Torsten Conrad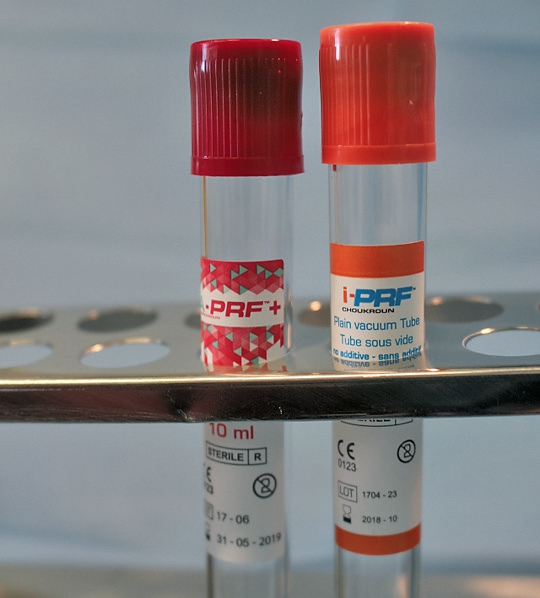 Dr. Torsten Conrad
Dr. Torsten Conrad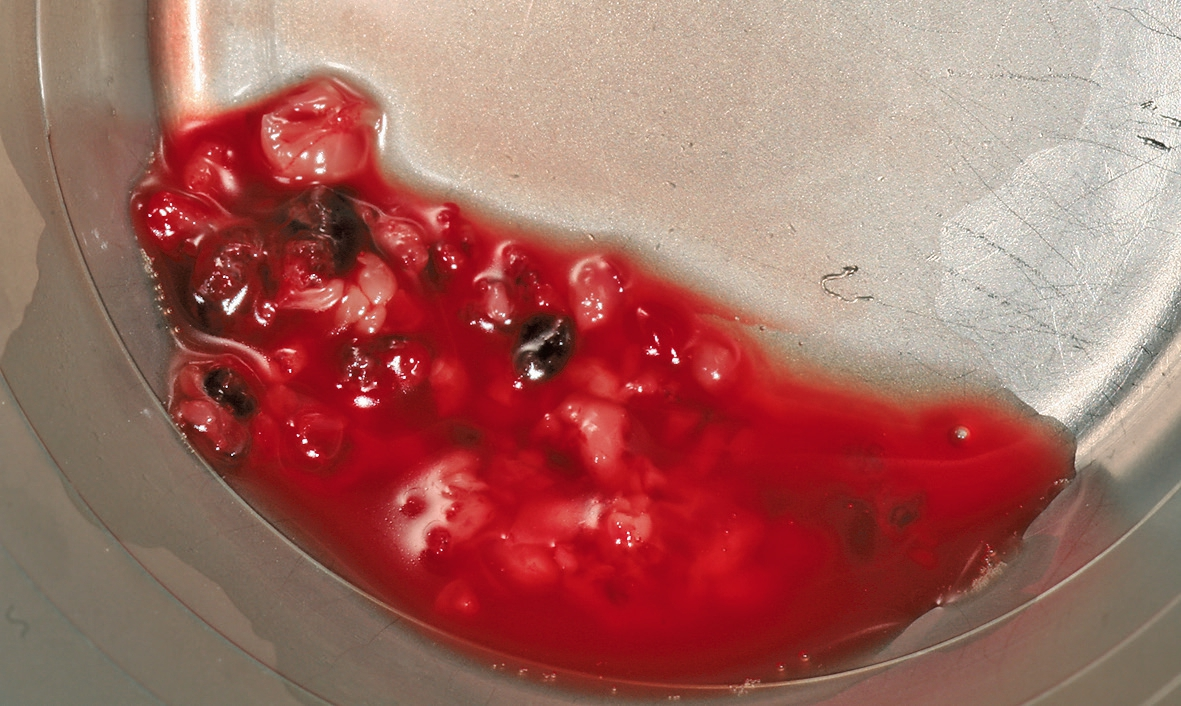 Dr. Torsten Conrad
Dr. Torsten Conrad Dr. Torsten Conrad
Dr. Torsten Conrad Dr. Torsten Conrad
Dr. Torsten Conrad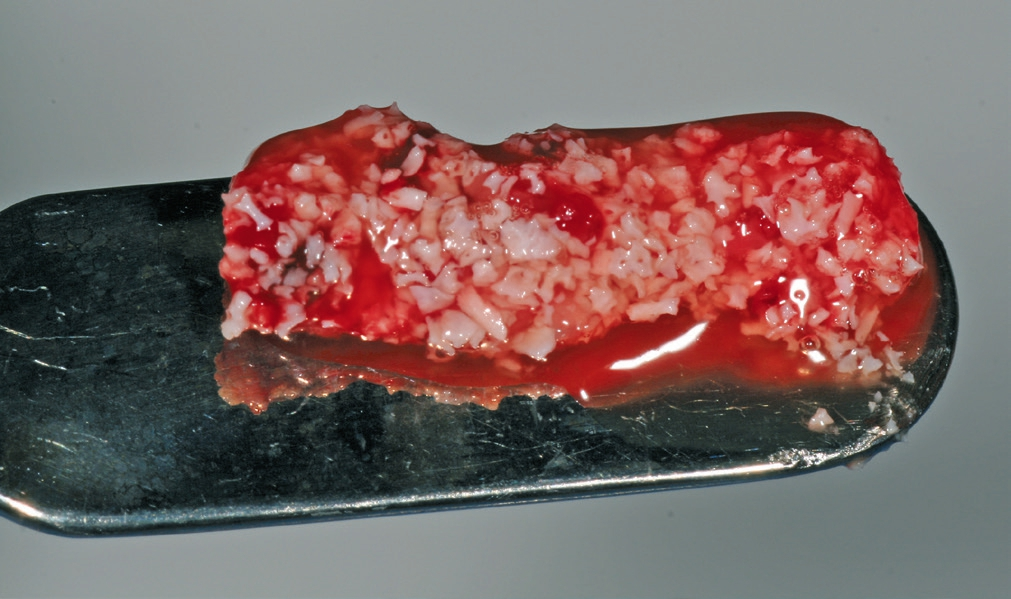 Dr. Torsten Conrad
Dr. Torsten Conrad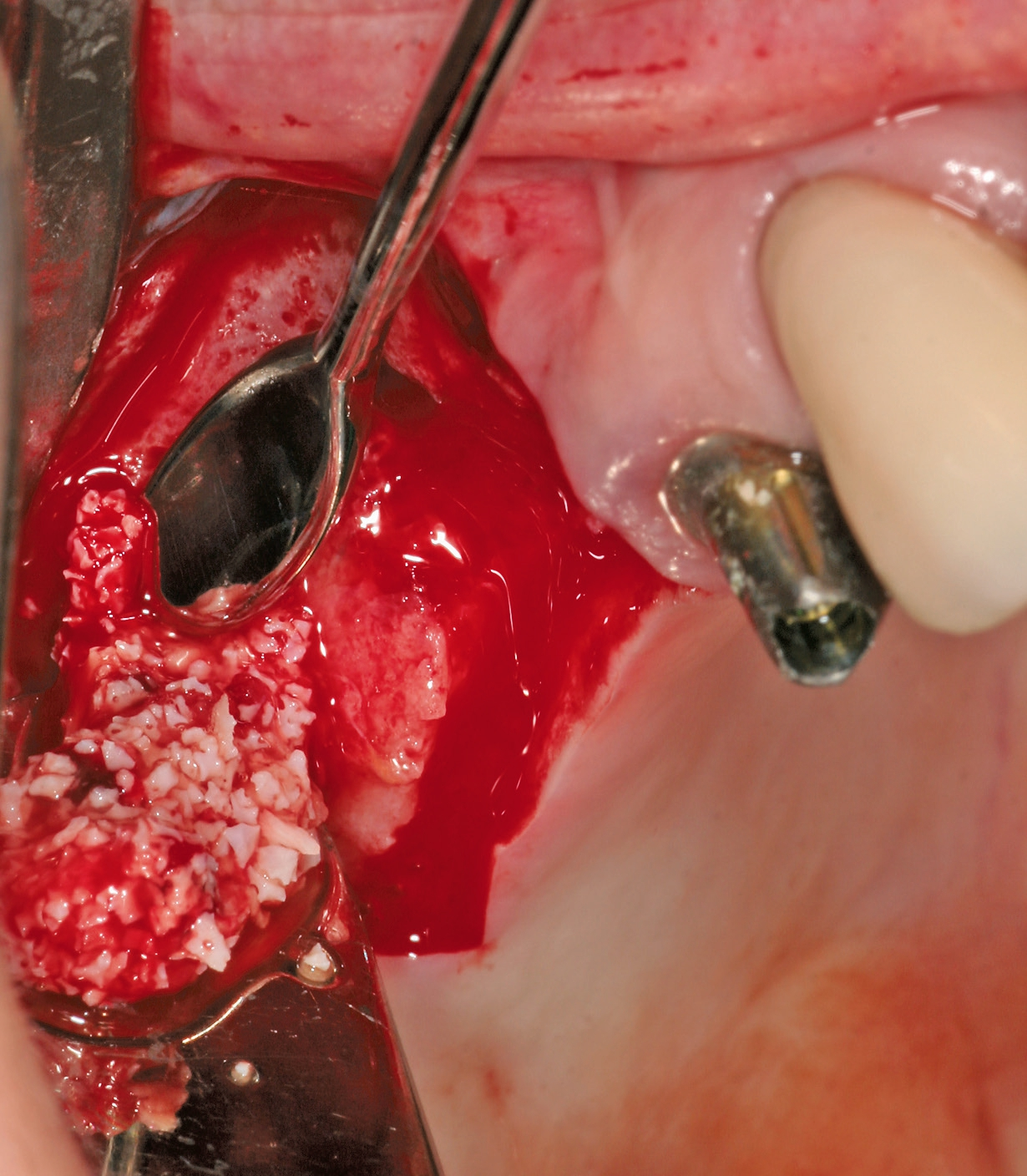 Dr. Torsten Conrad
Dr. Torsten Conrad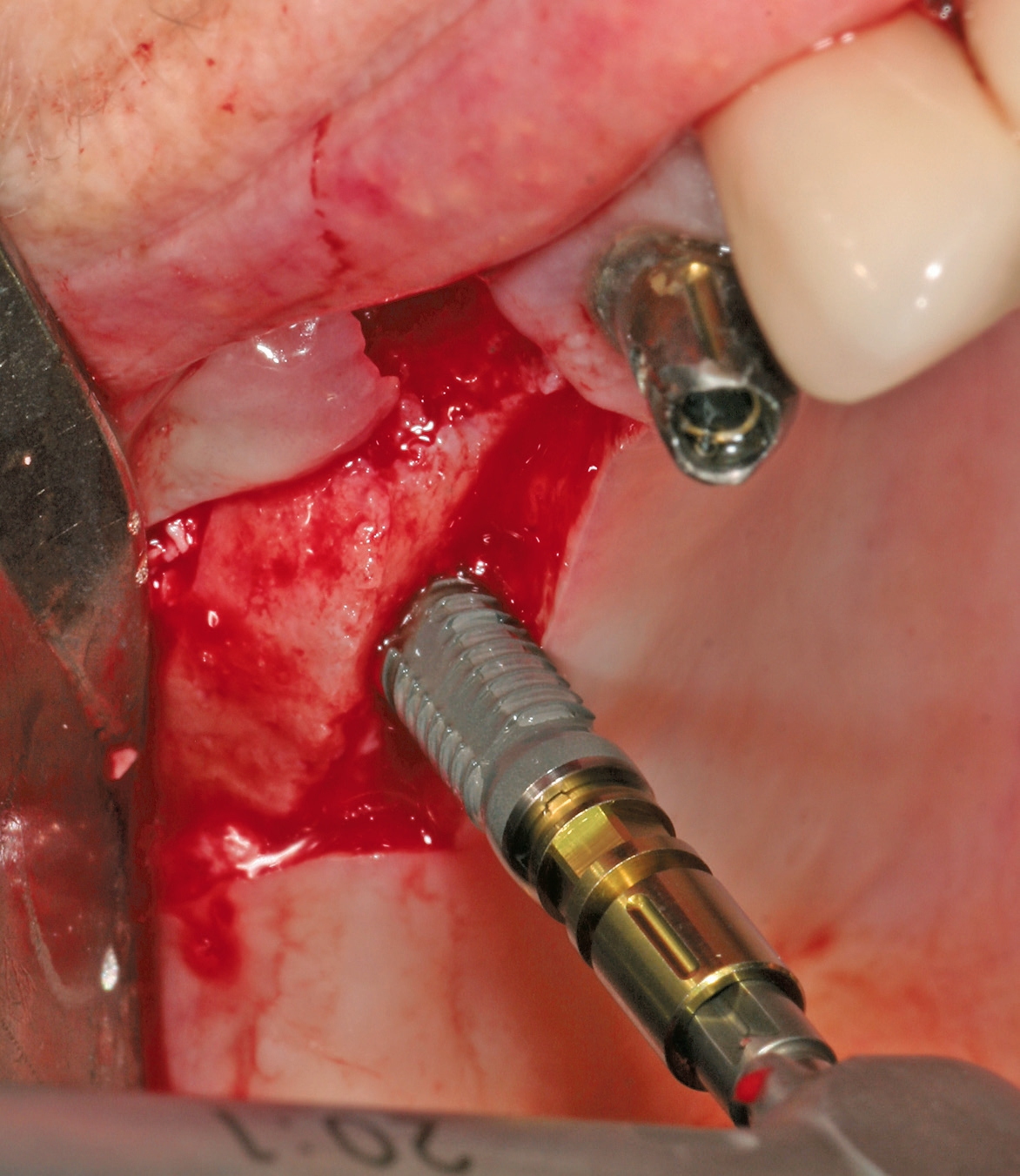 Dr. Torsten Conrad
Dr. Torsten Conrad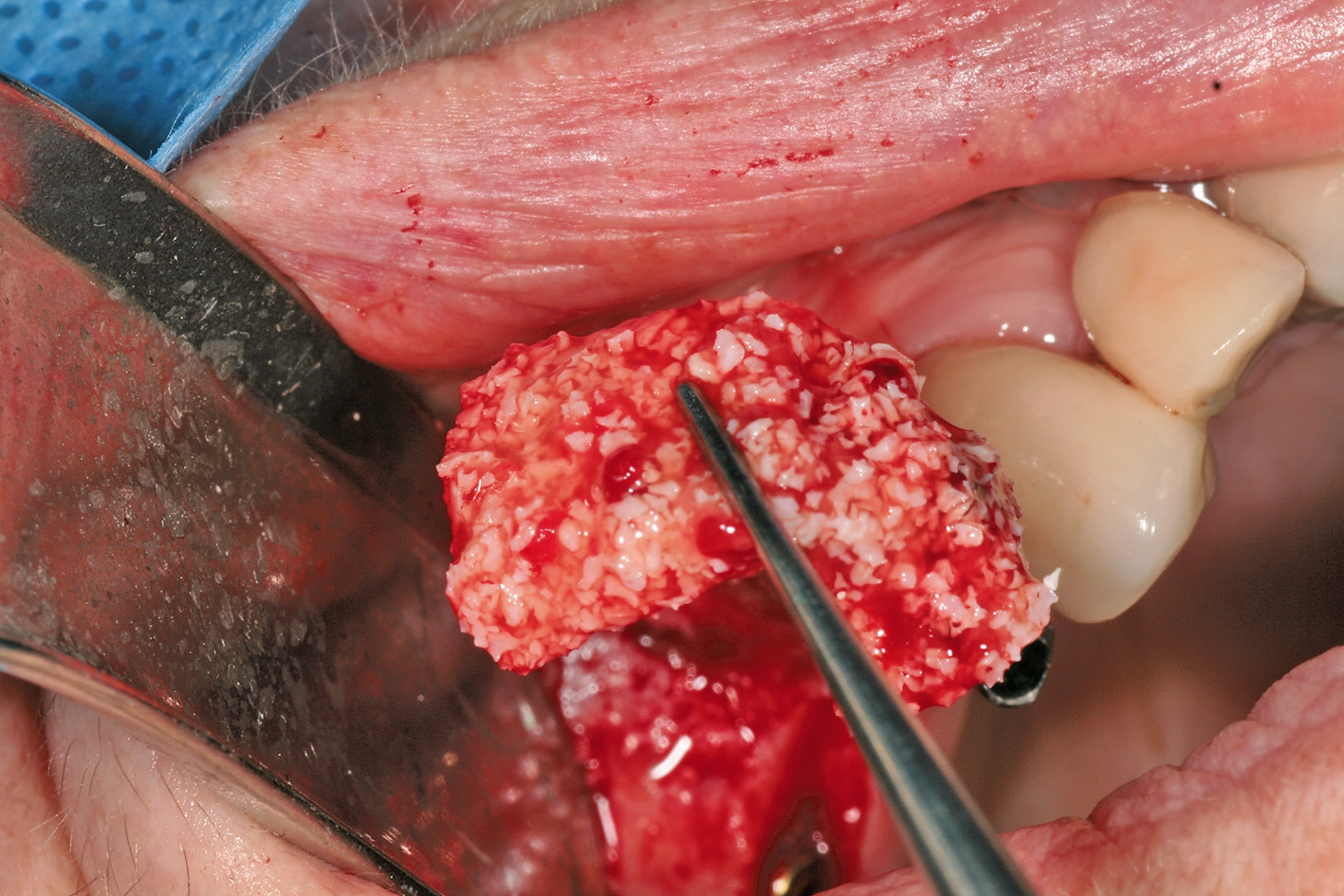 Dr. Torsten Conrad
Dr. Torsten Conrad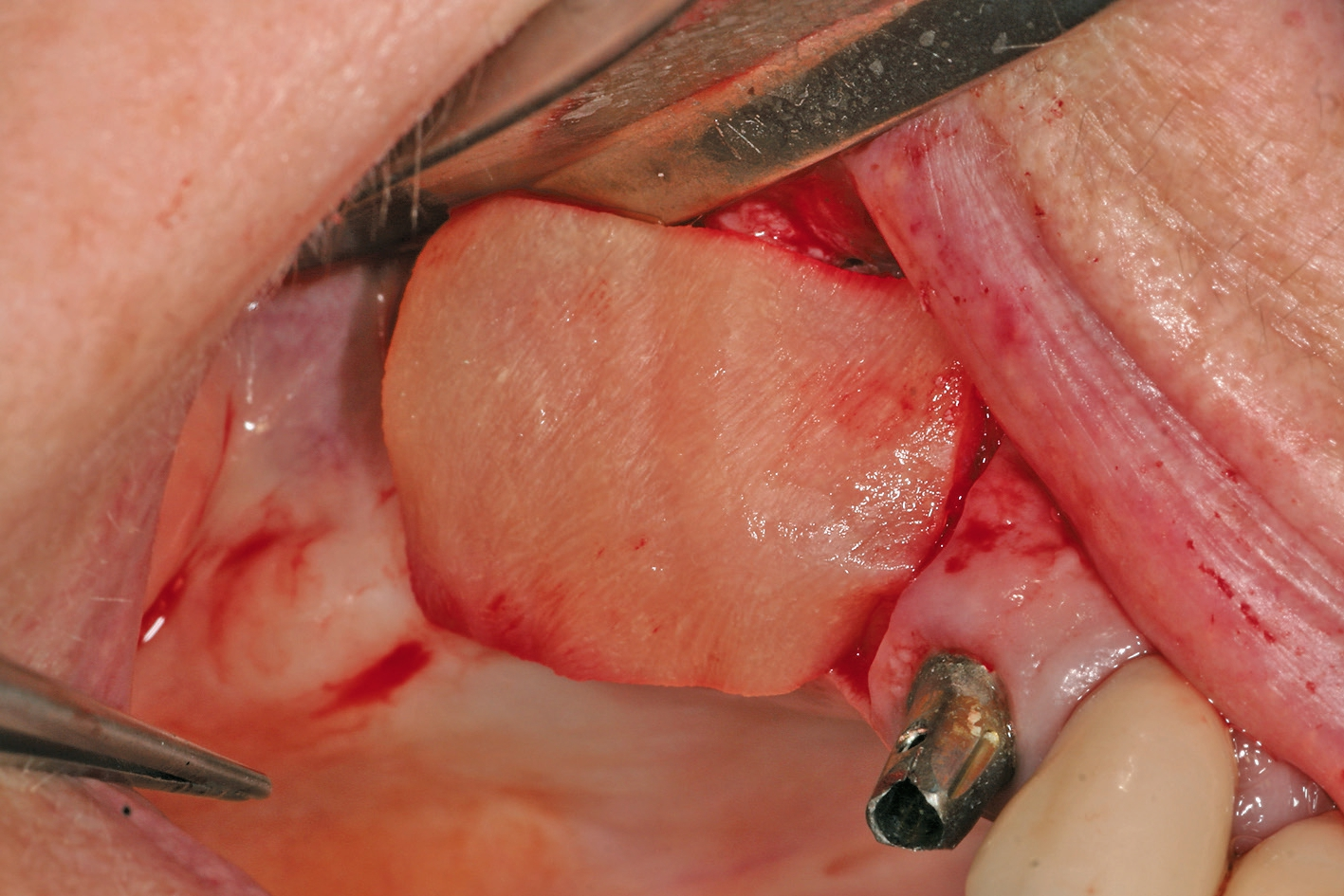 Dr. Torsten Conrad
Dr. Torsten Conrad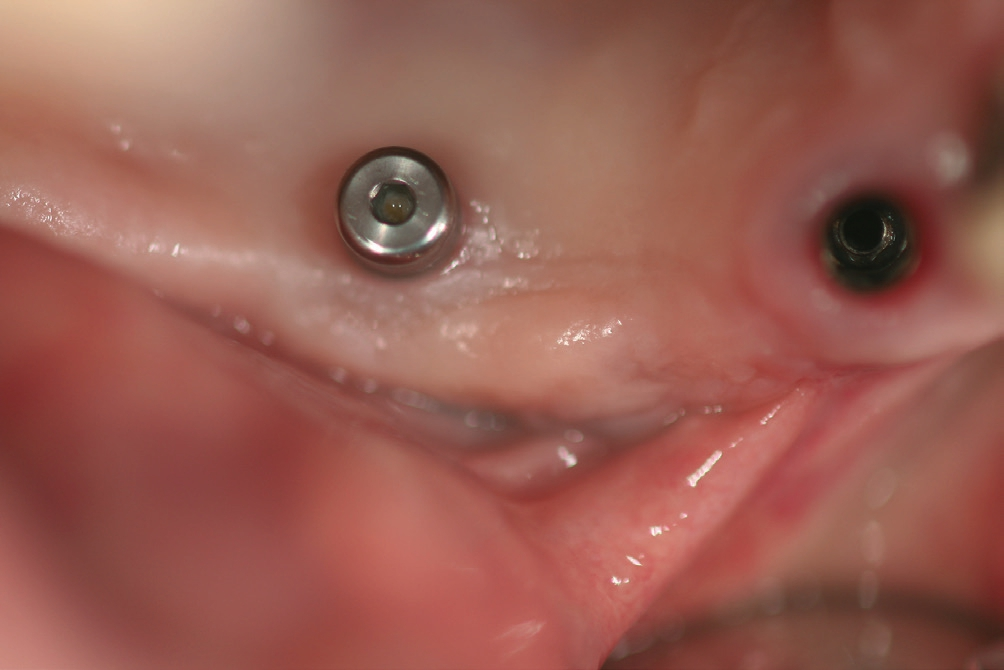 Dr. Torsten Conrad
Dr. Torsten Conrad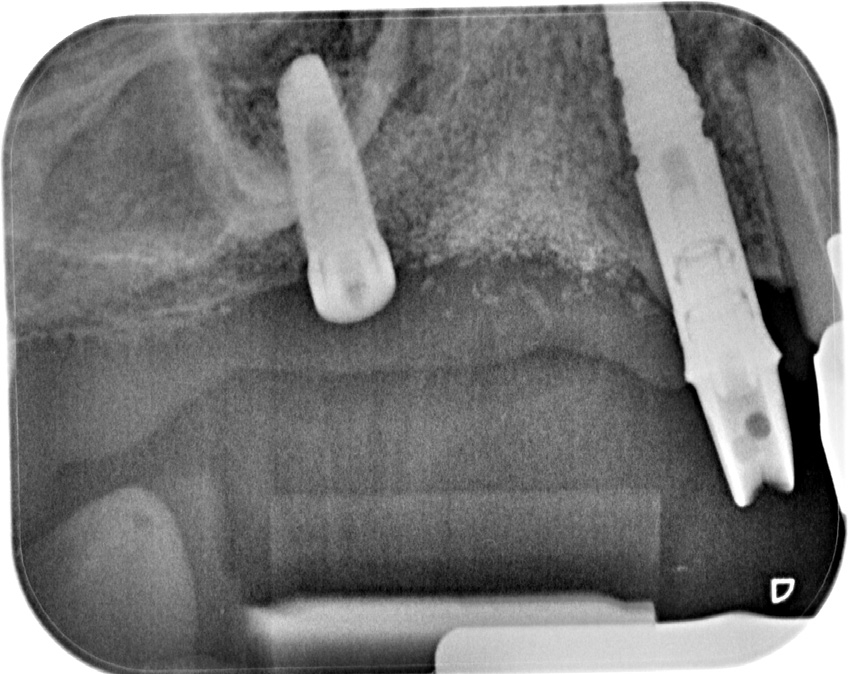 Dr. Torsten Conrad
Dr. Torsten Conrad
Klinische Indikationen
PRF wird in unterschiedlichen Indikationen der regenerativen Medizin und Zahnmedizin verwendet, vor allem in der Implantologie und Parodontologie. Das PRF kann sowohl als präventive Maßnahme im Rahmen der Socket Preservation als auch in den augmentativen Verfahren in Abhängigkeit von der Defektmorphologie und Größe allein oder in Kombination mit Knochenersatzmaterial verwendet werden. Diverse klinische Studien haben die Zuverlässigkeit des PRF als alleiniges Füllmaterial sowohl bei der Socket Preservation als auch beim Sinuslift bestätigt. Dabei hatten die gesetzten Implantate sechs Jahre nach Sinuslift eine Überlebensrate von 100 %. Eine Übersichtsarbeit von Ghanaati et al. zeigte, dass in sieben kontrollierten Studien zur chirurgischen Behandlung von Parodontitis mittels PRF versus einer konventionellen Lappenoperation eine statistisch signifikante Verbesserung der Sondierungstiefen und Attachmentverluste in der PRF-Gruppe erreicht werden konnte [25]. Ferner eignet sich PRF in der klinischen Anwendung aufgrund seiner autologen Quelle und Bioaktivität gut für die Behandlung von medikamentenassoziierten Kiefernekrosen. Da das Krankheitsbild eine Einschränkung der Vaskularisation und Regeneration zeigt, kann die Freisetzung von Wachstumsfaktoren (VEGF) die Vaskularisation und die von Epidermal Growth Factor (EGF) die Epithelialisierung fördern [26]. Diese Ergebnisse wurden in klinischen Studien beobachtet. Dennoch finden sich in der Literatur zahlreiche unterschiedliche Behandlungsprotokolle, die es erschweren, systematische Auswertungen der klinischen Daten und Metaanalysen durchzuführen. In diesem Sinne werden laufende systematische und kontrollierte klinische Studien mit den vorgestellten Protokollen die Überlegenheit des PRF in unterschiedlichen Indikationen zeigen müssen.
Fazit
PRF bietet eine autologe Alternative zur Kombination mit unterschiedlichen Biomaterialien, um die Regeneration in der präimplantologischen Chirurgie zu unterstützen. Zusätzlich zu seiner biologischen Aktivität erleichtert die Kombination der Biomaterialien mit PRF die klinische Anwendbarkeit und erlaubt somit eine Optimierung des Operationsverlaufs und Verkürzung der Operationszeit.
Näheres zu den Autoren des Fachbeitrages: Prof. Dr. Dr. Dr. Shahram Ghanaati, Prof. Dr. Dr. Dr. Robert Sader, Dr. Sarah Al-MaawiBildquellen sofern nicht anders deklariert: Unternehmen, Quelle oder Autor/-in des Artikels
 Entdecke CME Artikel
Entdecke CME Artikel  Entdecke Artikel mit Download
Entdecke Artikel mit Download 



 Mit Google einloggen
Mit Google einloggen
 Mit Facebook einloggen
Mit Facebook einloggen