Jürg Bolleter, Chairman der Dentalpoint AG, ließ es sich in seiner Eröffnungsrede nicht nehmen, sich speziell bei einigen Weggefährten der ersten Stunde von Zeramex zu bedanken, die das Unternehmen von der ersten bis zur fünften Implantatgeneration mit Rückmeldungen begleitet und damit die positive Entwicklung von Zeramex erst ermöglicht haben. Dank nachhaltiger Forschungsarbeit sowie der Erfahrung von mehr als 25.000 gesetzten Implantaten und einigen universitären Studien werden heute Einheilquoten in der Größenordnung von 98 % erreicht. Noch gelte Titan als Goldstandard in der Implantologie, so Bolleter. Laut offizieller Aussage auf dem kürzlich stattgefundenen ITI-Kongress sei jedoch in den nächsten 5 bis 10 Jahren mit einem Anstieg des Keramikanteils auf 30 bis 50 % zu rechnen.
Gewebeintegration Keramik vs. Titan: Was ist anders und was gleich?
Zur Einführung in das Thema nahm Prof. Dr. sc. nat. Dieter Bosshardt, Leiter Robert K. Schenk Labor für Orale Histologie, Universität Bern, die Gewebeintegration von Keramik- und Titanimplantaten genauer unter die Lupe und erörterte anhand aktueller Studienlage die Gemeinsamkeiten und Unterschiede. Zum Auftakt zitierte er eine klassische Arbeit zur Weichgewebsheilung von Implantaten von Berglundh et al. (1991), die zu der Schlussfolgerung kamen, dass sowohl die Gingiva als auch die periimplantäre Mukosa die Eigenschaften besitzen, die es braucht, um subgingivale Plaqueentstehung zu verhindern [1]. Den Beleg, dass Keramikimplantate hinsichtlich der Weichgewebeintegration den Titanimplantaten in nichts mehr nachstehen, lieferte Bosshardt mithilfe einiger präklinischer, tierexperimenteller In-vivo-Studien.
So stellten Kohal et al. (2004) fest, dass die Dimensionen der Weichgewebe um Implantate aus Titan (Ti) und Zirkoniumdioxid (ZrO2) vergleichbar sind, es also keine Unterschiede in der biologischen Breite gibt [2]. Welander et al. konnten 2008 nachweisen, dass Abutments sowohl aus Ti als auch ZrO2 sehr gute Voraussetzungen für die Einheilung im Weichgewebe bieten, wobei weniger Leukozyten im Saumepithel um die ZrO2-Abutments als bei den Titansystemen vorhanden waren, was als ein kleiner Vorteil zuguns- Mehr als 120 Teilnehmer sind am 12. und 13. Mai der Einladung des Schweizer Unternehmens Dentalpoint AG zum 6. Internationalen ZERAMEX-Kongress nach Hamburg gefolgt. Renommierte Referenten aus Wissenschaft und Klinik boten eine umfassende aktuelle Standortbestimmung zum Einsatz von Zirkoniumdioxid in der Implantologie und zogen einen wissenschaftlich fundierten Vergleich zum derzeit noch als Goldstandard geltenden Titan. ten von ZrO2 interpretiert werden kann [3]. Die Dimensionen des Saumepithels waren Gegenstand der Untersuchung von Koch et al. (2013), und auch hier zeigten die Ergebnisse keine signifikanten Unterschiede in der Mukosahöhe und Saumepithellänge zwischen Materialien (Ti/ZrO2) und Heilungsmodalitäten (Einheilung offen oder gedeckt) [4]. Im Hinblick auf die Osseointegration haben physikalische und chemische Oberflächenmodifikationen bei Titanimplantaten und gewissen Titanlegierungen zu einer Reduktion des Stabilitätseinbruchs durch schnellere Knochenapposition auf das Implantat geführt. Studien haben gezeigt, dass durch Zunahme der Oberflächenrauheit [5] und chemische Aktivierung der Oberfläche [6,7] der Osseointegrationsprozess beschleunigt und die Einheilzeiten reduziert werden können. Auch bei Keramikimplantaten haben modifizierte Oberflächen einen statistisch signifikanten Einfluss auf den Bone-Implant-Contact (BIC) sowie die Ausdrehmomente: In einem Tierexperiment wurden die besten Werte nach Sandstrahlung und anschließender Säureätzung erreicht [8]. Chappuis et al. konnten beim Vergleich verschiedener Materialien (Ti, ZrO2 und Mischkeramiken [Zirkoniumdioxid und Aluminiumoxid]) für alle drei Implantate eine komplikationslose, überzeugende Osseointegration ohne Entzündungszeichen demonstrieren [9].
In einer aktuellen, bisher noch unveröffentlichten tierexperimentellen Studie untersuchten Janner et al. Titan- und Zirkoniumdioxidimplantate nach 4 und 16 Wochen unter Belastung. Die Resultate: Nach 4 Wochen waren beide Implantate wunderbar osseointegriert und die Knochenbildung noch voll im Gange, die nach 16 Wochen zur Ruhe kam. Es gab keinen Implantatverlust, keine Fraktur und auch keine Lockerung und zu beiden Beobachtungszeiten keine signifikanten Unterschiede bzgl. des Knochenkontaktes zum Implantat (BIC) und der Knochendichte (gemessen in der Nähe des Implantates). Zum Abschluss nannte Bosshardt noch überzeugende humanhistologische Daten mit Seltenheitswert, die nur dank „glücklicher Unglücksfälle“ zu bekommen sind: Die nach 2 bzw. einem Jahr in situ explantierten Zirkoniumdioxidimplantate zeigten eine herausragende Knochenanlagerung mit durchschnittlichen BIC-Werten bis zu 95 %.
Periimplantitis ist ein Begriff aus der Titanwelt

Diese Ergebnisse legen den Verdacht nahe, dass die biologischen Komplikationen bei Titan- und ZrO2-Implantaten offenbar unterschiedlicher Natur sind. Untermauert wurde diese Annahme u. a. mit der Studie von Nascimento et al. (2014), die die Bakterienadhäsion auf Plättchen aus Titan und Zirkon untersuchten und herausfanden, dass sich die wenigsten Beläge auf dem Zirkonplättchen gebildet hatten [13]. Dass Gewebe unterschiedlich auf das Vorhandensein von Zirkon und Titan reagieren, zeigten auch Degidi et al. (2006): Sie haben auf Titanimplantate sowohl Zirkon- als auch Titanabutments gesetzt und weniger Entzündungsmarker beim Kontakt des Gewebes mit Zirkon als mit Titan nachweisen können [14]. Vergleichbar dazu beobachteten Cionca et al. (2016) bei neun Patienten mit Implantaten aus beiden Materialien signifikant weniger Plaquebefall auf dem ZrO2- als auf dem Titanimplantat [15]. Mombelli kam zu der Schlussfolgerung, dass Periimplantitis ein Begriff aus der Titanwelt zu sein scheint und aus gegenwärtiger Sicht mit noch unvollständiger Evidenz bei ZrO2-Implantaten kein wichtiges Problem darstellt. Daher könnten Implantate aus diesem Material insbesondere bei Menschen, die gewisse Risikofaktoren haben, eine probate Lösung sein.
Titanimplantate – eine kritische Betrachtung des „Goldstandards“

Hinsichtlich der Entzündungsreaktionen auf Titanpartikel haben bestimmte Patienten eine individuelle bzw. genetische Prädisposition. Diese gilt es bereits vor Behandlungsbeginn herauszufiltern, um den Langzeiterfolg der Implantattherapie nicht zu gefährden. Jacobi-Gresser stellte eine eigene retrospektive Studie zur Überprüfung von Laborparametern für die individuelle Risikoeinschätzung eines Implantatverlustes bei zahnmedizinischen Titanimplantationen vor. Hier erwiesen sich ein positiver Titanstimulationstest und die Anzahl an Risikogenotypen als jeweils unabhängige und auch von den anderen bekannten Risikofaktoren wie Rauchen, Alter und Geschlecht unabhängig assoziierte Risikofaktoren für die Entwicklung einer Periimplantitis und einen Titanimplantatverlust [16]. Die Bestimmung der Risikogenotypen und die Durchführung des Titanstimulationstests stellen somit prädiktive Laborparameter für den Erfolg von zahnmedizinischen Titanimplantationen dar und erlauben eine individuelle Risikoevaluierung. Das Untersuchungsergebnis kann sowohl vor einer Implantation eine wesentliche Entscheidungshilfe im Hinblick auf eine alternative Materialwahl sein als auch bei kurativen Fragestellungen nach erfolgter Implantation. Der Vollständigkeit halber sei hinzugefügt, dass vergleichbare Reaktionen auf Zirkonimplantate aufgrund einer stabileren, korrosionsfesteren Oberfläche und einer deutlich geringeren immunogenen Wirkung von Zirkonpartikeln bisher nicht nachgewiesen worden sind.
Praktische Erfahrungen mit Keramikimplantaten
Nachdem nun im ersten großen Vortragsblock die biologischen Eigenschaften von Titan und Zirkon ausführlich beleuchtet und die Unterschiede bzw. Gemeinsamkeiten herausgearbeitet worden waren, eröffnete Dr. med. dent. Axel Scheffer die Diskussion über die für den Prothetiker relevanten praktischen Fragestellungen zum Einsatz von Keramikimplantaten. Auf die Frage „Frontzahnästhetik – kennen wir den schmalen Grat?“ stellte er zunächst fest, dass eine komplette Wiederherstellung der Frontzahnästhetik insbesondere vom Patienten zwar wünschenswert, aber nicht immer machbar ist. Anhand von zwei Patientenfällen konnte er anschließend eindrücklich demonstrieren, wie die hochsensible vestibuläre Knochenlamelle im Frontzahngebiet erhalten bzw. wieder aufgebaut werden kann: Er löste diese problematische Ausgangssituation mit einem ZERAMEX® P6-Implantat in über 80 % augmentiertem Knochen sowie im zweiten Fall mit einer ZERAMEX® P6-Implantation als Sofortimplantation mit einem Straumann® Guided Surgery Kit.
Aber auch in anderen Bereichen bieten die Zeramex® Keramikimplantate neue Perspektiven, resümierte Scheffer. Durch ihren Einsatz wird seiner Ansicht nach der kieferorthopädische Lückenschluss zur obsoleten Behandlungsoption. In diesem Zusammenhang forderte er seine Kollegen auf, gemeinsam einen Gegenpol aufzubauen und Patienten über die kieferorthopädischen Lösungen hinaus zu informieren.

ZTM Wolfgang Weisser, Dozent und Dentalfotograf, demonstrierte anhand eines Patientenfalles Schritt für Schritt die einzelnen Planungs- und Behandlungsphasen einer innovativen Versorgung aus zahntechnischer Sicht. Dabei ging es ihm vor allem darum, zu zeigen, wie wichtig und wünschenswert die Kommunikation und der fachliche Austausch zwischen Zahnarzt und Zahntechniker für einen langfristigen Therapieerfolg sind. Aufgrund der Komplexität der Behandlungsfälle ist eine enge interdisziplinäre Zusammenarbeit eine wesentliche Voraussetzung für eine sinnvolle prothetische Planung und Versorgung, die am Ende des Tages auch wirklich funktioniert.
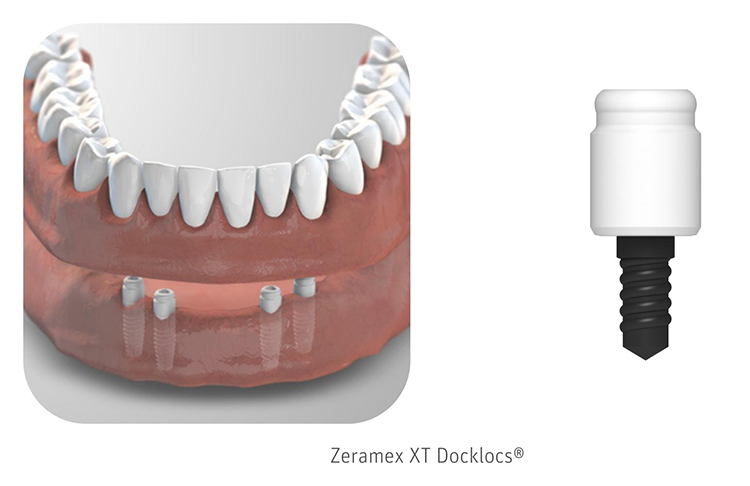
Zeramex® XT: metallfrei verschraubt – the next generation

Wie bei Zeramex® P6 werden auch Zeramex® XT-Implantat und Abutment aus hochverdichteten, gehippten Zirkondioxid- ATZ-Rohlingen hergestellt und erfüllen die hohen Anforderungen an Festigkeit, biomechanische Stabilität und Passgenauigkeit. Die Elemente der neuen Bolt-in-Tube-Verbindung sind so gestaltet, dass sie eine sehr hohe Stabilität bieten und trotzdem die Materialeigenschaften von Keramik berücksichtigen. Dank der variablen Setztiefe und der innovativen Innenverbindung kann der Aufbau der Krone frei gestaltet und das Weichgewebe wie gewünscht konditioniert werden.
Die vier Zinnen, die die Implatatverbindung bringen, dienen ausschließlich der Rotationssicherung. Das Kernstück der Verbindung ist wie bei Zeramex® P6 die Vicarbo®-Schraube aus karbonfaserverstärktem Hightechkunststoff, dessen enorme isoelastische Eigenschaften für eine hochfeste und formschlüssige, jedoch spannungsfreie, verschraubte Keramik- Keramik-Verbindung sorgen. Das Resumee von Tartsch: „Für mich ist der Kreis jetzt eigentlich ziemlich geschlossen. Mit dem Zeramex® XT haben wir ein fast Bone-Level-Implantat gegenüber dem Tissue-Level-Design des P6, wir haben die Frontzahn- und die Molarenregion, die Früh- und die Spätimplantation und wir haben die konische und die zylindrische Form – beides metallfrei, reversibel, verschraubt.“ Und mit der Antwort auf die Frage: „Warum Zeramex?“ brachte es Tartsch am Ende eines spannenden Kongresstages kurz und knapp auf den Punkt: „Weil es funktioniert!“
Weiterführende Literatur:
- Berglundh T et al.: The soft tissue barrier at implants and teeth. Clin Oral Implants Res 2 (2), 81–90 (1991).
- Kohal RJ et al.: Loaded custom-made zirconia and titanium implants show similar osseointegration: an animal experiment. J Periodontol 75 (9), 1262–1268 (2004).
- Welander M et al.: The mucosal barrier at implant abutments of different materials. Clin Oral Implants Res 19 (7), 635–641 (2008).
- Koch FP et al.: Soft tissue healing at one-piece zirconia implants compared to titanium and PEEK implants of identical design: a histomor phometric study in the dog. Int J Periodontics Restorative Dent 33 (5), 669–977 (2013).
- Buser D et al.: Influence of surface characteristics on bone integration of titanium implants. A histomorphometric study in miniature pigs. J Biomed Mater Res 25 (7), 889–902 (1991).
- Buser D et al.: Enhanced bone apposition to a chemically modified SLA titanium surface. J Dent Res 83 (7), 529–533 (2004).
- Bosshardt DD et al.: The role of bone debris in early healing adjacent to hydrophilic and hydrophobic implant surfaces in man. Clin Oral Implants Res 22 (4), 357–364 (2011).
- Saulacic N et al.: Acid and alkaline etching of sandblasted zirconia implants: a histomorphometric study in miniature pigs. Clin Implant Dent Relat Res 16 (3), 313–322 (2014).
- Chappuis V et al.: Osseointegration of zirconia in the presence of multinucleated giant cells. Clin Implant Dent Relat Res 18 (4), 686–698 (2016).
- Mombelli A et al.: The epidemiology of peri-implantitis. Clin Oral Implants Res 23 (6), 67–76 (2012).
- Derks J et al.: Effectiveness of implant therapy analyzed in a Swedish population: prevalence of peri-implantitis. J Dent Res 95 (1), 43–49 (2016).
- Cionca N et al.: Two-piece zirconia implants supporting all-ceramic crowns: a prospective clinical study. Clin Oral Implants Res 26 (4), 413–418 (2015).
- Nascimento CD et al.: Bacterial adhesion on the titanium and zirconia abutment surfaces. Clin Oral Implants Res 25 (3), 337–343 (2014).
- Degidi M et al.: Inflammatory infiltrate, microvessel density, nitric oxide synthase expression, vascular endothelial growth factor expression, and proliferative activity in peri-implant soft tissues around titanium and zirconium oxide healing caps. J Periodontol 77 (1), 73–80 (2006).
- Cionca N et al.: Pro-inflammatory cytokines at zirconia implants and teeth. A cross-sectional assessment. Clin Oral Investig 20 (8), 2285–2291 (2016).
- Jacobi-Gresser E et al.: Genetic and immunological markers predict titanium implant failure: a retrospective study. Int J Oral Maxillofac Surg 42 (4), 537–43 (2013).
- Kajiwara N et al.: Soft tissue biological response to zirconia and metal implant abutments compared with natural tooth: microcirculation monitoring as a novel bioindicator. Implant Dent 24 (1), 37–41 (2015).
- Vindasiute E et al.: Clinical factors influencing removal of the cement excess in implant-supported restorations. Clin Implant Dent Relat Res 17 (4), 771–778 (2015).
Bildquellen sofern nicht anders deklariert: Unternehmen, Quelle oder Autor/-in des Artikels
 Entdecke CME Artikel
Entdecke CME Artikel  Entdecke Artikel mit Download
Entdecke Artikel mit Download 




 Mit Google einloggen
Mit Google einloggen
 Mit Facebook einloggen
Mit Facebook einloggen
Keine Kommentare.