|
Getting your Trinity Audio player ready...
|
Parodontitis ist eine chronische, multifaktorielle und entzündliche Erkrankung, die mit der Ansammlung eines subgingivalen Biofilms einhergeht und durch eine fortschreitende Zerstörung des Zahnhalteapparats, einschließlich des parodontalen Ligaments und des Alveolarknochens, gekennzeichnet ist. An der Erkrankung sind komplexe dynamische Wechselwirkungen zwischen spezifischen bakteriellen Erregern, destruktiven Immunreaktionen des Wirts und Umweltfaktoren wie z.B. Rauchen oder Diabetes beteiligt. Weltweit leiden etwa 11% der Weltbevölkerung an einer schweren Parodontitis, von der 743 Millionen Menschen betroffen sind [1]. Chronische Parodontitis wirkt sich negativ auf die mundgesundheitsbezogene Lebensqualität (OHRQoL) aus, während eine erfolgreiche Behandlung die OHRQoL der Patienten und Patientinnen verbessern kann [2,3]. Parodontitis hat erhebliche Auswirkungen auf die systemische Gesundheit und wird derzeit mit 50 Systemerkrankungen in Verbindung gebracht [4].
Zahnbelag ist ein archetypischer Biofilm, der aus einer komplexen mikrobiellen Gemeinschaft besteht. Er ist die Ursache der wichtigsten oralen Erkrankungen wie Karies und Parodontitis. In einem gesunden Zustand befinden sich Biofilm und parodontales Gewebe in einem empfindlichen Gleichgewicht, das eine symbiotische Beziehung zwischen beiden herstellt [5]. Bei einem anfälligen Wirt führt eine Verschiebung der mikrobiellen Zusammensetzung im subgingivalen dentalen Biofilm durch parodontale Pathogene, insbesondere durch eine Gruppe spezifischer gramnegativer anaerober Spezies, die als roter Komplex bekannt sind, zu einer chronischen Entzündung. Zu den Bakterien des roten Komplexes gehören Porphyromonas gingivalis, Tannerella forsythia und Treponema denticola, die vor allem in tiefen Parodontaltaschen von Patienten/-innen mit Parodontitis zu finden sind [1,6–8]. Der subgingivale dentale Biofilm löst dann eine Entzündungs- und Immunreaktion des Wirts aus, die das Parodontium irreversibel zerstört und zu Entzündungen der Gingiva, klinischem Attachmentverlust, Alveolarknochenverlust, erhöhten Sondierungstiefen, Zahnlockerungen und Blutung bei Sondieren führt [1].
Möglicherweise führen auch metabolische Veränderungen in der mikrobiellen Gemeinschaft zu ersten Stadien der Dysbiose. Bestimmte metabolische Signaturen hingegen scheinen unabhängig von der Zusammensetzung der mikrobiellen Gemeinschaft mit dem Fortschreiten der Krankheit einherzugehen. So könnte es auch sein, dass die gesamte mikrobielle Gemeinschaft und nicht bestimmte Erreger für eine Zunahme der Virulenz verantwortlich ist [9]. Darüber hinaus wird vermutet, dass eine Abnahme der Alpha-Diversität ein Anzeichen für eine Krankheit, ja sogar ein Prädiktor sein könnte [10,11]. Diese Dysbiose und die daraus entstehende Parodontitis haben, wie bereits erwähnt, über die Zahnmedizin hinaus eine Bedeutung: Entsprechende Wechselwirkungen und ein bedeutender Einfluss auf unterschiedliche Volkskrankheiten wurden nachgewiesen (Diabetes mellitus Typ 2, kardiovaskuläre Erkrankungen). Umso wichtiger ist es daher, Parodontitis erfolgreich zu behandeln.
Therapie der Parodontitis
Die aktuelle Klassifikation sieht eine Einteilung in vier Parodontitisstadien vor, denen jeweils noch ein Grading A bis C zugeordnet werden kann. Die Stadien geben dabei den Schweregrad der Parodontitis an, während das Grading die Geschwindigkeit der Progression beschreibt. In der aktuellen S3-Leitlinie „Die Behandlung von Parodontitis Stadium I–III“ wird folgendes Stufenschema zur Behandlung der unterschiedlichen Stadien vorgeschlagen: In einer ersten Stufe soll u.a. die Mundhygiene verbessert, der supragingivale Biofilm kontrolliert sowie Risikofaktoren (Raucherentwöhnung, Ernährungslenkung, metabolische Kontrolle eines Diabetes) erkannt und besprochen werden. Darüber hinaus findet ein Professional Mechanical Plaque Removal (PMPR) statt. In einer zweiten Stufe (ursachenbezogene Therapie) erfolgt die Reduktion/Entfernung des subgingivalen Biofilms und Zahnsteins mittels manueller bzw. maschineller Instrumentierung (subgingivale Instrumentierung). Zusätzlich können adjuvante Anwendungen, wie z.B. die systemische Gabe von Antibiotika, erforderlich sein.
Zeigt sich nach der Reevaluation von Therapiestufe 2, dass die Endpunkte der Behandlung noch nicht erreicht sind (keine parodontalen Taschen > 4 mm mit Bluten auf Sondieren oder keine tiefen parodontalen Taschen ≥ 6 mm), soll Therapiestufe 3 (chirurgisches Vorgehen) in Betracht gezogen werden. Nach erfolgreicher Therapie mit Erreichen der Endpunkte folgt in einer vierten Therapiestufe die unterstützende Parodontitistherapie (UPT) in regelmäßigen patientenindividuellen Intervallen, um die parodontale Stabilität aufrecht zu erhalten. Sie umfasst u.a. die Instrumentierung des subgingivalen Biofilms, die Kontrolle der Risikofaktoren und Mundhygienekontrollen [12].
Probiotika
„Probiotikum“ ist ein Hybridwort aus dem Lateinischen und Griechischen und bedeutet „für (das) Leben“. Es handelt sich hierbei um „lebende Mikroorganismen, die bei entsprechend adäquater Anzahl einen Nutzen für den Wirt darstellen“, so die Definition der Food and Agriculture Organization (FAO) der Vereinten Nationen (VN) und der World Health Organization (WHO) [13]. Probiotika werden schon länger in der Allgemeinmedizin zur Behandlung der Darmmikrobiota und damit verbundener Erkrankungen eingesetzt (Diabetes, chronisch-entzündliche Darmerkrankungen, Adipositas) [13]. Auch in der Zahnmedizin werden Probiotika zur Beeinflussung der oralen Mikrobiota im Rahmen der Behandlung von u.a. einer Parodontitis oder von Karies genutzt [14]. Ihre genaue Wirkungsweise in Bezug auf die orale Mikrobiota ist nicht abschließend geklärt [15].
Probiotika für die Mundhöhle können in Form von Lutschtabletten, Kautabletten oder Mundspüllösungen eingenommen bzw. angewendet werden. Zu den häufig eingesetzten Spezies gehören Lactobacillus reuteri, Lactobacillus rhamnosus und Bifidobakterien. Bereits mehrfach untersucht ist die Wirkung von L. reuteri. Der Effekt von Probiotika im Zusammenhang mit Parodontitis ist vor allem im Rahmen der antiinfektiösen Therapie als Adjuvans zur subgingivalen Instrumentierung erforscht worden. In der aktuellen S3-Leitlinie zur Behandlung der Parodontitis werden Probiotika als adjuvante Gabe zur subgingivalen Instrumentierung (Behandlungsstufe 2) nicht empfohlen. Die Leitlinie befasst sich darüber hinaus nicht mit der Evidenz von Probiotika im Rahmen der Nachsorge.
Dabei ist im Zusammenhang mit Probiotika gerade und vor allem die Nachsorge von Interesse: Sie ist die spannende Phase der Therapie, da die aktive Therapie vorbei ist, es nur noch wenige parodontale Resttaschen gibt und daher beinahe „saubere Verhältnisse“ herrschen. In dieser Phase kann nun versucht werden, die ursprüngliche physiologische Mikrobiota mittels Probiotika zu etablieren. Erst kürzlich wurden hierzu Studien veröffentlicht, welche die Wirkung der Probiotika in Therapiestufe 4 untersucht haben.
Probiotika in der Nachsorge – die Studienlage
Es gibt aktuell zwei Studien [16,17], die die Wirkung von Probiotika – in diesem Fall jeweils Lactobacillus reuteri (DSM 17938 und ATCC PTA 5289) – explizit in der Nachsorge untersucht haben. Zwei weitere Studien [18,19] haben die Wirkung von L. reuteri (DSM 17938 und ATCC PTA 5289) auf residuelle Taschen untersucht, welche nach Definition und Leitlinie nicht den Endpunkten der Therapie und damit der Nachsorge entsprechen. Die beiden Studien zum Effekt von Probiotika in der Nachsorge und ihre Ergebnisse werden nachfolgend genauer vorgestellt.
Studie I: Grusovin et al.
In der ersten Studie von Grusovin et al. [16] wurden 20 Patienten/-innen mit Parodontitis im Stadium III und IV, Grad C (acht Männer und zwölf Frauen im Alter zwischen 31 und 70 Jahren) zufällig auf zwei Gruppen aufgeteilt. Sie befanden sich alle in der Nachsorge, wobei eine vorherige Antibiotikaeinnahme (in den drei Monaten zuvor) u.a. als Ausschlusskriterium von der Studie galt. Die Testgruppe erhielt insgesamt über drei Monate zweimal täglich eine L.-reuteri-haltige Lutschtablette, die die Probanden jeweils nach dem Zähneputzen lutschten. Danach folgte eine dreimonatige „Auswaschphase“ ohne L.-reuteri-Lutschtabletten. Anschließend wurde das gleiche Prozedere weitere sechs Monate wiederholt. Währenddessen bekam die Kontrollgruppe zweimal täglich eine Plazebo-Lutschtablette. Follow-up-Kontrollen erfolgten nach drei, sechs, neun und zwölf Monaten. Die Ausgansuntersuchung fand drei Monate nach der antiinfektiösen Therapie statt (Therapiestufe 2). Primärer Endpunkt der Studie war die Veränderung der Sondierungstiefen, als sekundäres Ziel wurden Parameter wie Bluten auf Sondieren, Komplikationen und Beeinträchtigungen, Zahnüberleben, Clinical Attachment Level (CAL) und Veränderung des Prozentsatzes an Stellen mit Sondierungstiefen > 4 mm festgelegt. Nach drei und neun Monaten, also nach der ersten und zweiten Einnahme der probiotischen Lutschtablette, füllten die Probanden Fragebögen zur Therapiezufriedenheit und individuellen Mundgesundheit aus.
Studie I: Ergebnisse
Die durchschnittliche Sondierungstiefe hat sich in beiden Gruppen nach zwölf Monaten statistisch signifikant reduziert, wobei die Probiotikagruppe besser abgeschnitten hat. Während innerhalb der Plazebogruppe nach sechs Monaten keine statistisch signifikante Veränderung zu verzeichnen war, konnten innerhalb der Probiotikagruppe bei allen Follow-up-Kontrollen statistisch signifikante Unterschiede festgestellt werden. Zwischen den Gruppen zeigten sich ebenfalls zu allen Zeitpunkten statistisch signifikante Unterschiede. Die Ergebnisse im Einzelnen: In beiden Gruppen kam es zu klinisch moderaten Verbesserungen (Baseline/zwölf Monate: Plazebogruppe 2,23 mm/1,92 mm, Probiotikagruppe 2,23 mm/1,76 mm). Zwischen den Gruppen können damit keine wesentlichen klinischen Unterschiede festgestellt werden. Während der Auswaschphase (sechs Monate, neun Monate) haben sich innerhalb der Probiotikagruppe die Sondierungstiefen weiter reduziert. Der Unterschied hinsichtlich der Veränderung des prozentualen Anteils an parodontalen Taschen über 4 mm war zwischen den beiden Gruppen nicht statistisch signifikant. Es zeigten sich in beiden Gruppen klinisch moderate Verbesserungen (Baseline/zwölf Monate: Plazebogruppe 4,39%/2,64%, Probiotikagruppe 4,39%/1,95%). Zwischen den Gruppen können damit keine wesentlichen klinischen Unterschiede festgestellt werden. In der Probiotikagruppe führte die Auswaschphase zu einer weiteren Reduktion des prozentualen Anteils der parodontalen Taschen über 4 mm.
Das durchschnittliche CAL verbesserte sich in beiden Gruppen statistisch signifikant zu allen Zeitpunkten. Zwischen den Gruppen zeigte sich ein statistisch signifikanter Unterschied zum Zeitpunkt von sechs Monaten. Die Verbesserung des CAL war in beiden Gruppen klinisch moderat (Baseline/zwölf Monate: Plazebo- und Probiotikagruppe 3,24 mm/2,74 mm). Zwischen den Gruppen können damit keine klinischen Unterschiede festgestellt werden. Während der Auswaschphase zeigten sich in der Probiotikagruppe Verbesserungen des Clinical Attachement Levels. Das Bluten auf Sondieren hat sich in beiden Gruppen zu allen Zeitpunkten statistisch signifikant verbessert. Zwischen den Gruppen zeigten sich statistisch signifikante Unterschiede nach sechs und neun Monaten. In beiden Gruppen waren klinisch deutliche Verbesserungen zu verzeichnen (Baseline/zwölf Monate: Plazebogruppe 22,42%/11,10%, Probiotikagruppe 22,42%/10,80%). Zwischen den Gruppen können damit keine wesentlichen klinischen Unterschiede festgestellt werden. Die Auswaschphase zeigte in der Probiotikagruppe keine einheitlichen Effekte. Des Weiteren konnten keine Komplikationen oder Beeinträchtigungen sowie Zahnverlust innerhalb der untersuchten zwölf Monate festgestellt werden.
Studie II: Thierbach et al.
Die Frage bzgl. der Dosierung bzw. Häufigkeit und der Einnahmedauer des Probiotikums blieb zunächst ungeklärt, bis sich im Jahr 2024 eine weitere Studie dieser Thematik annahm. Thierbach et al. [17] untersuchten, inwieweit mit einer Minimaldosis von einer Lutschtablette am Tag und einer minimalen Einnahmedauer von drei Monaten ein klinischer Effekt erzielt werden kann. 28 Patienten/-innen mit Parodontitis Stadium III und IV wurden zufällig auf zwei Gruppen verteilt. Die Testgruppe lutschte das Verum (L. reuteri), die Kontrollgruppe ein Plazebo für insgesamt 90 Tage einmal täglich morgens nach dem Zähneputzen. Eine Antibiotikaeinnahme sechs Monate vor oder grundsätzlich während der Studie galt als Ausschlusskriterium. Zu Beginn der Untersuchung sowie nach vier, acht und zwölf Wochen wurden Rezessionen, Bluten auf Sondieren (Primäres Outcome), Sondierungstiefen, Clinical Attachment Level (CAL) und der Plaque Control Record (PCR) erhoben.
Studie II: Ergebnisse
Es zeigten sich keine statistisch signifikanten Unterschiede zwischen Plazebo- und Probiotikagruppe beim CAL, bei Sondierungstiefen (in mm) und dem PCR. Statistisch signifikant war der Unterschied zwischen Plazebo- und Probiotikagruppe bei Bluten auf Sondieren. Klinisch waren moderate Verbesserungen zugunsten der Probiotikagruppe nach vier und zwölf Wochen zu verzeichnen (Abb. 1). Die Studie führte auch eine interessante patientenindividuelle Analyse durch, die unterschiedliche Verläufe ergab: Teilweise verschlechterten sich sogar die Befunde, teilweise blieben sie unverändert. Bei anderen Patienten/-innen wiederum zeigten sich durchaus Verbesserungen der klinischen Parameter. Insgesamt konnten keine Komplikationen oder Beeinträchtigungen festgestellt werden.
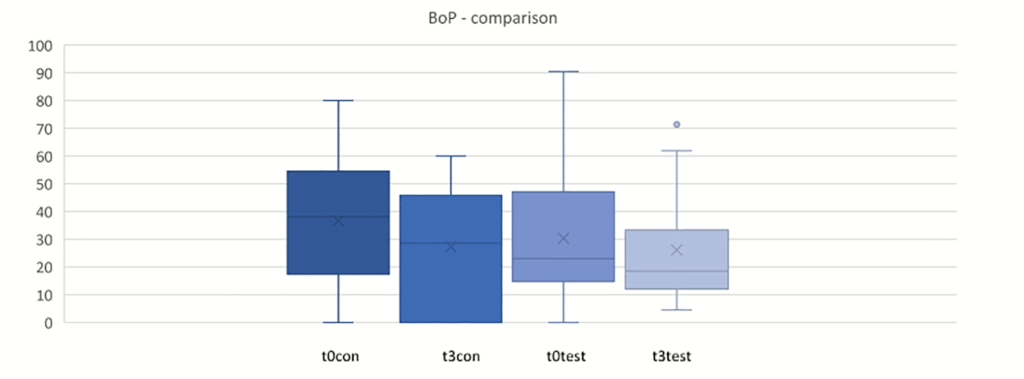
Abb. 1: Vergleich der Blutung auf Sondierung (BoP) zwischen t0 und t3.
t0con = t0 Kontrolle/t3con = t3 Kontrolle (12 Wochen); t0test = t0 Test/t3test = t3 Test (12 Wochen)
Kontrolle = Placebo + unterstützende Parodontitistherapie (UPT), Test = Probiotikum + UPT, p < 0.05 (Grafik: © MDPI)
Fazit
Bis zum jetzigen Zeitpunktsind keine wirklich klinisch überzeugenden Effekte von Probiotika in der parodontalen Nachsorge nachgewiesen worden. In Einzelfällen können jedoch durchaus Verbesserungen einzelner klinischer Befunde wie z.B. Bluten auf Sondieren festgehalten werden. Aktuell kann keine Bewertung abgegeben werden, ob Probiotika in der Nachsorge eine sinnvolle Therapiemöglichkeit darstellen. Es fehlen prospektive klinische Studien mit ausreichenden Fallzahlen und vergleichbaren Studiendesigns (Protokoll der Einnahme, Dosierung, Zeitraum der Einnahme), um eine wissenschaftlich valide Aussage treffen zu können. Dabei gilt es zu beachten, dass die bisherigen Ergebnisse nicht auf andere Probiotika oder L.-reuteri-Stämme übertragbar sind. Insbesondere sollten zukünftige Studien mikrobiologische Untersuchungen durchführen, um die Veränderungen der oralen Mikrobiota abhängig von Dosierung, Zeitraum und Zeitpunkten der Einnahme zu analysieren. Grundsätzlich gilt als Einschränkung zu beachten, dass während der Studien nicht abschließend überprüft werden kann, ob Patienten/-innen das Probiotikum wirklich lutschten oder möglicherweise nur schluckten oder gar nicht eingenommen haben. Möglicherweise werden unter Beachtung all dieser Kriterien auch zukünftig nur limitierte Effekte der Probiotika nachweisbar sein, da die individuelle subgingivale Mikrobiota nicht einheitlich mit einem oder mehreren standardisierten Stämmen behandelt werden kann. Nur intensive Forschung und ein patientenindividueller Forschungsansatz werden diese Frage beantworten können.
 Entdecke CME Artikel
Entdecke CME Artikel  Entdecke Artikel mit Download
Entdecke Artikel mit Download 


 Mit Google einloggen
Mit Google einloggen
 Mit Facebook einloggen
Mit Facebook einloggen
Keine Kommentare.