Wissenschaftlich anerkannt, führt eine bakterielle Infektion des Pulpagewebes über mehrere Stufen, wie einer reversiblen und irreversiblen Pulpitis, schließlich zu einer apikalen Parodontitis [1]. Spätestens im Stadium einer apikalen Parodontitis liegt die weit überwiegende Form der Bakterien in einer organisierten Struktur, dem Biofilm vor [2]. Dabei handelt es sich um Konglomerate unterschiedlicher Bakterienspezies, welche durch eine auf Oberflächen wie zum Beispiel dem Dentin festhaftende extrapolysaccharide Matrix miteinander verbunden sind [3]. Die bakterielle Kolonisation der Wurzelkanalsysteme erfolgt in der Natur somit größtenteils in Form von Biofilm. Dabei ist ein Fakt unbestritten: Im Biofilm organisierte Bakterien sind bei weitem resistenter gegenüber antimikrobiellen Agentien als dies beispielsweise planktonische, also in Gewebsflüssigkeit schwimmende Bakterien wären [4]. Mit diesem immer tieferen mikrobiologischen Wissen erweitert sich auch das Verständnis zu endodontischen Infektionen. So gilt heute das „community as pathogen“-Konzept als gesichert. Es besagt, dass die Erkrankung, beispielsweise eine apikale Parodontitis, das Resultat vieler unterschiedlicher pathogener Spezies darstellt [5]. Selbst bei ein und derselben Erkrankung herrscht bei der Zusammensetzung der einzelnen Spezies des Biofilms eine große interindividuelle Diversität vor [6] (Abb. 1). Das bedeutet, dass dieselbe Erkrankung bei 2 verschiedenen Individuen durch sehr unterschiedliche Bakterienspezies ausgelöst werden kann. In den unterschiedlichen Arten endodontischer Infektionen (primäre, sekundäre, persistierende und extraradikuläre) konnten in einer Vielzahl von Studien allein bis ins Jahr 2009 mehr als 500 verschiedene Bakterienspezies sowie Pilze und Archaea nachgewiesen werden [7].
Eine Reihe morphologischer Studien konnte Aufschluss über die „Kolonisationsmuster“ der Bakterien und des Biofilms im Wurzelkanalsystem geben. Bei der Mehrzahl der im Hauptkanal vorkommenden Bakterien handelt es sich um an den Dentinwänden festhaftende Biofilme [8]. Aus therapeutischer Sicht finden sich Biofilme leider aber auch in allen anatomischen Anomalien wie lateralen Kanälen, Ramifikationen, Kanalunregelmässigkeiten oder aber auch den Dentintubuli [9]. Diese Bereiche sind hinsichtlich einer umfassenden Desinfektion extrem herausfordernd [10] und können eine mögliche Quelle für Misserfolge darstellen. Auch die Verteilung der Bakterien im Wurzelkanalsystem ist von fundamentaler Bedeutung. So postulierten Abott et al., dass die Mehrzahl der Bakterien im koronalen Anteil des Wurzelkanalsystems vorkommt. Weiterhin finden sich ebenfalls mehr als die Hälfte der Bakterien im inneren Wurzelkanaldrittel, während sich im äußeren Anteil nur etwa 10% der Bakterien befinden [11]. Aus diesen Fakten können wichtige therapeutische Erkenntnisse abgeleitet werden. Einerseits ist eine gewisse Präparationsgröße der inneren Wurzelkanalwände sinnvoll, um in diesem Bereich eine bestmögliche mechanische Reinigung zu gewährleisten. Andererseits benötigen wir Spülflüssigkeiten und deren Aktivierung, um die weiter außen liegenden Bereiche des Wurzelkanalsystems so gut wie möglich reinigen zu können. Auch eine ausreichende koronale Präparation zu Beginn unserer Aufbereitung führt zu einer primären Bakterienreduktion. Zusammenfassend ergeben sich aus diesen Überlegungen mehrere elementare biologische Ziele der endodontischen Therapie [12]:
• Entfernung von Mikroorganismen und Biofilm
• Entfernung infizierter Gewebe
• Bakteriendichter Verschluss der Hohlraumsysteme
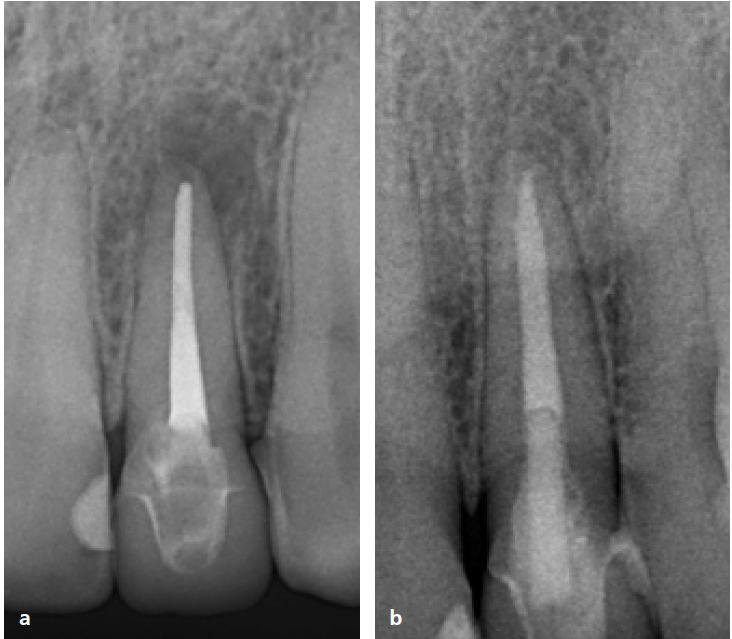
Endodontische Therapie bedeutet also nichts anderes als den therapeutischen Versuch, die Bakterienlast innerhalb des Wurzelkanalsystems so weit abzusenken, dass dem Körper eine möglichst vollständige Regeneration der pathologischen Prozesse ermöglicht wird. Das heißt wir versetzen das Immunsystem in die Lage, eine nahezu vollständige Heilung erreichen zu können (Abb. 2a und b).
 Schlichting
SchlichtingApikale Parodontitis: mehr als „nur“ eine Zahnerkrankung
Bereits seit Längerem deuteten Erkenntnisse auf einen möglichen Zusammenhang zwischen Allgemeinerkrankungen und Zähnen mit apikaler Pathologie hin. In den letzten Jahren ist es gelungen, diesen Zusammenhang in mehreren Studien zu belegen. So konnte eine signifikante Korrelation zwischen kardiovaskulären Erkrankungen und Patienten/-innen mit apikaler Parodontitis (AP) nachgewiesen werden. Bei dieser Patientengruppe konnte in hohen Konzentrationen insbesondere das Protein KCNK3 nachgewiesen werden, das eine entscheidende Rolle bei der Entwicklung der arteriellen Hypertonie einnimmt [13]. In einer weiteren Studie haben die Autoren einen signifikanten Zusammenhang zwischen Entzündungsmarkern im peripheren Blut und Zähnen mit apikalen Parodontitiden hergestellt. Auch hier konnte bei jungen (!) Erwachsenen ein erhöhtes Risiko für kardiovaskuläre Erkrankungen nachgewiesen werden [14].
Zahlreiche Studien haben den Zusammenhang zwischen Diabetes Mellitus Typ II und AP beschrieben [15,16]. Dabei deutet vieles darauf hin, dass es gerade bei AP und Diabetes Typ 2 eine in beide Richtungen weisende Verbindung gibt. So scheinen Patienten/-innen mit Diabetes Typ II viel häufiger AP zu entwickeln als gesunde Kontrollgruppen [17]. Umgekehrt entwickelten Patienten/-innen mit AP häufiger Diabetes Mellitus Typ II. So kann AP zu erhöhten Blutglukose-Konzentrationen führen und den Insulinspiegel im Blut beeinflussen [18]. Es scheint auch einen möglichen Zusammenhang zwischen AP und Frühgeburten zu geben. So konnte bei Schwangeren mit AP eine signifikant höhere Rate an Frühgeburten festgestellt werden [19]. Auch Autoimmunerkrankungen wie Psoriasis, Colitis ulcerosa oder rheumatoide Arthritis weisen eine höhere Prävalenz an AP auf [20]. Diese Aufzählung möglicher Zusammenhänge zwischen AP und Allgemeinerkrankungen könnte noch lange fortgeführt werden. Letztendlich zeigen diese Beispiele aber, dass die Therapie der AP weitreichendere Ziele verfolgt als „nur“ den Erhalt der eigenen Zähne.
Die Therapie: weniger invasiv, aber genauso gründlich
Betrachtet man die wissenschaftlichen Publikationen der letzten Jahre, zeichnet sich ein deutlicher Trend ab: Eine möglichst weniger invasive Vorgehensweise als noch vor ein paar Jahren, ohne aber die bereits oben erwähnten biologischen Ziele der endodontischen Therapie zu vernachlässigen [21]. Ermöglicht wurde dies aber erst durch die Entwicklung unterschiedlichster Methoden und technischer Neuerungen. Dazu zählen unter anderem das Dentalmikroskop, das DVT, moderne NiTi-Feilensysteme, Fortschritte bei der Aktivierung unserer Desinfektionsflüssigkeiten sowie moderne Obturationsmaterialien und Techniken. Einige dieser Aspekte sollen im Folgenden beschrieben werden.
Die Zugangskavität
Die Qualität der Zugangskavität stellt einen der entscheidenden Schritte für eine erfolgreiche endodondontische Therapie dar [22]. Didaktisch können bei der Gestaltung der Zugangskavität 2 Arbeitsschritte unterschieden werden: Der geradlinige Zugang zu den Wurzelkanaleingängen („straight line access“), und die Gestaltung des koronalen Kanaleinganges, also der koronalen 3 bis 4 mm des Wurzelkanals („coronal preflaring“). Ohne an dieser Stelle auf die Diskussion um die „ideal dimensionierte“ Zugangskavität eingehen zu wollen, möchte ich aber betonen, dass sowohl ein geradliniger Zugang als auch eine vernünftige koronale Gestaltung der Wurzelkanaleingänge unabdingbar für eine erfolgreiche endodontische Therapie und damit den langfristigen Zahnerhalt sind.
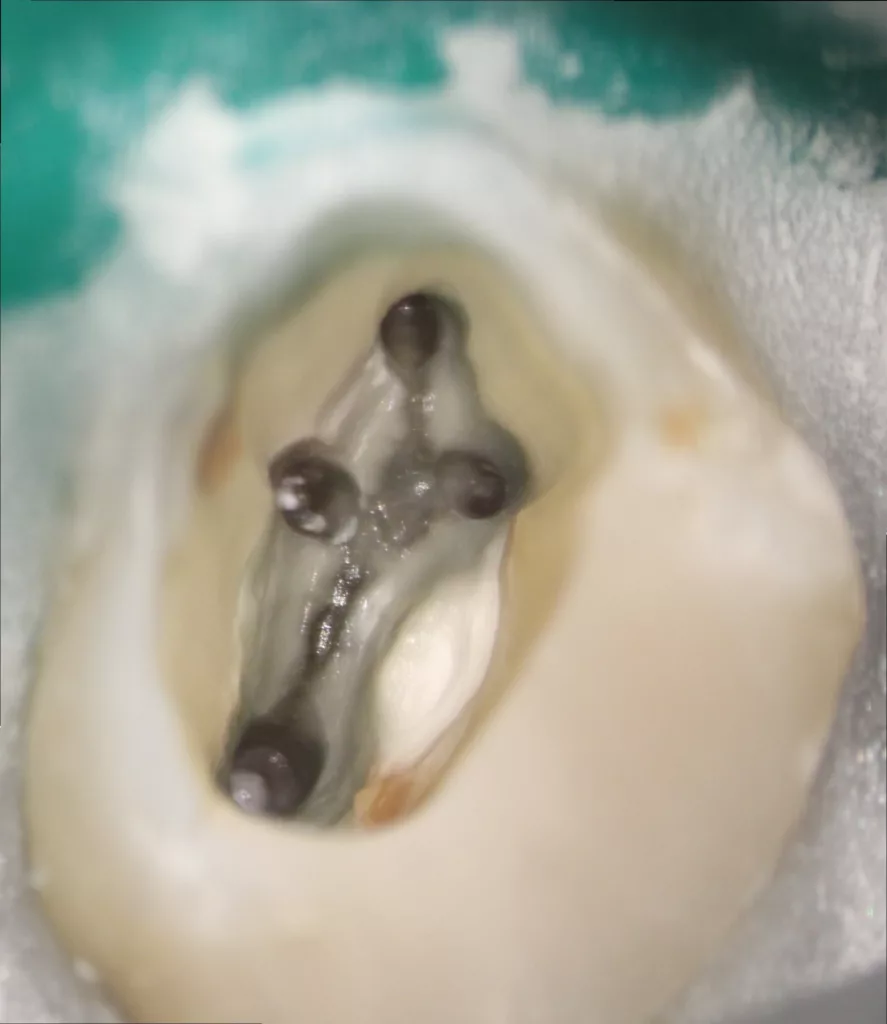
Die Präparation eines geradlinigen Zuganges soll einerseits einen direkten Blick auf die Wurzelkanaleingänge ermöglichen und zum anderen sicherstellen, dass alle für die folgenden Verfahrensschritte notwendigen Instrumente geradlinig in den Wurzelkanal eingebracht werden können. Der initiale Zugang zu den Wurzelkanaleingängen sollte in etwa eine „Ameisentrichterform“ aufweisen. Ziel ist es, allen Instrumenten ein „Hineingleiten“ in den koronalen Abschnitt des WK-Systems zu ermöglichen. Dazu können sowohl Gates Glidden Bohrer, aber auch speziell für diesen Zweck entwickelte rotierende NiTi-Instrumente verwendet werden. Vorteile des „coronal preflaring“ gibt es viele. So wird durch eine Verringerung der Torsionsbelastung das Risiko für Instrumentenfrakturen reduziert [23], es kommt zu einem verbesserten Austausch von Desinfektionslösung im koronalen Bereich [24] sowie zu weniger iatrogenen Aufbereitungsfehlern und verbessertem Abtransport von Debris [25] (Abb. 3).
In den letzten Jahren kam es zu sehr intensiven Diskussionen über die „ideale“ Gestaltung der Zugangskavität. Grundsätzlich steht das Bestreben im Vordergrund, möglichst viel Dentin zu erhalten. Gerade ein Bereich 4 mm über und unterhalb des krestalen Knochens, das sogenannte „perizervikale Dentin“, sollte erhalten bleiben, da es für die Frakturresistenz des Zahnes entscheidend sei [26]. In der Literatur ist eine Vielzahl unterschiedlicher Bezeichnungen für diese „contracted cavities“ vorgeschlagen worden (Abb. 4), was zusätzlich zu einer Verwirrung innerhalb der Diskussion beiträgt [27]. Mittlerweile ist eine Reihe von Studien zu diesem Thema mit kontroversen Ergebnissen publiziert worden. Während einige wenige Studien Vorteile hinsichtlich der Frakturresistenz wurzelbehandelter Zähne beschreiben [28,29], konnte die Mehrzahl der Studien keine Vorteile erkennen [30–32].
Wie so häufig ist die Diskussion um eine möglichst kleine Zugangskavität vielschichtig. Eine entscheidende Frage ist, über welche Ausstattung die Behandler/-innen verfügen. So führt allein die Nutzung des Dentalmikroskopes zu einer signifikanten Verbesserung der Qualität der Zugangskavität [33], was unter anderem auch eine Schonung von mehr gesunder Zahnhartsubstanz beinhalten kann. Die Möglichkeit einer dreidimensionalen Bildgebung mittels DVT kann ebenfalls einen erheblichen
Einfluss auf die Ausdehnung der Zugangskavität haben [34]. Welche Feilen stehen zur Verfügung und auf welche Möglichkeiten der Aktivierung der Spülflüssigkeit (Schall, Ultraschall oder aber Laser) kann zurückgegriffen werden? Ein weiterer wichtiger Faktor ist auch die Erfahrung der Behandler/-innen [35]. All diese Aspekte sind in dieser Diskussion zu berücksichtigen. Generell kann sicherlich tendenziell mit höherwertiger technischer Ausstattung und größerer Erfahrung der Behandler/-innen minimalinvasiver gearbeitet werden.
 Schlichting
Schlichting![Abb. 4: Unterschiedlich gestaltete Zugangskavitäten [117]](https://dentalwelt.spitta.de/wp-content/uploads/2024/05/Bild-4-1024x504.webp) Schlichting
SchlichtingNiTi-Feilen der neuesten Generation
Im Bereich der NiTi-Feilen zeigt sich besonders eindrucksvoll, welche wichtige Rolle technische und wissenschaftliche Innovationen für unsere tägliche Behandlung mit sich bringen können. Die meisten Behandler/-innen wünschen sich ein sicheres, einfaches und effizientes Feilensystem, um die Mehrzahl der Patientenfälle mit einem zufriedenstellenden Ergebnis behandeln zu können. Gerade die Sicherheit stellt für viele Behandler/-innen einen entscheidend wichtigen Aspekt dar [36]. Im Hinblick auf die Frakturresistenz haben Feilen der neuesten Generation gegenüber „älteren“ Feilen deutliche Vorteile. Wie ist es aber gelungen, die Feilensicherheit zu verbessern? Hier sind 2 entscheidende Entwicklungsschritte zu erwähnen: zum einen bei der Nachbehandlung der NiTi-Feilen (Abb. 5), zum anderen bei der Kinematik der zur Verfügung stehenden Endodontiemotoren (Abb. 6).
![Abb. 5: Methoden zur Nachbehandlung von NiTi [118]](https://dentalwelt.spitta.de/wp-content/uploads/2024/05/Bild-5-1024x218.webp) Schlichting
Schlichting![Abb. 6: Veränderungen in der Kinematik [119].](https://dentalwelt.spitta.de/wp-content/uploads/2024/05/Bild-6-1024x240.webp) Schlichting
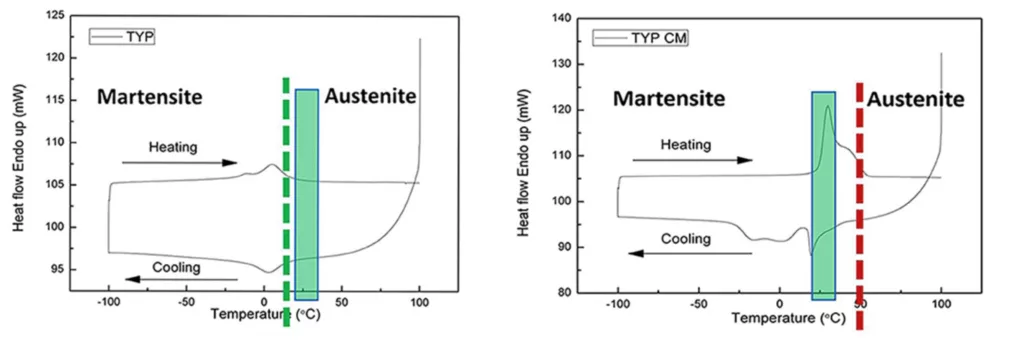
SchlichtingBetrachtet man den 1. Aspekt, die „Nachbehandlung“ der NiTi-Feilen nach deren Herstellung, gilt es 2 wesentliche Unterschiede zu berücksichtigen. Bei der mechanischen Nachbehandlung durch sogenanntes „electropolishing“ werden während des Herstellungsprozesses entstandene Oberflächenunregelmässigkeiten beseitigt. Dies steigert die Frakturresistenz der Feilen signifikant [37]. Die andere Möglichkeit ist heute deutlich populärer. Dabei handelt es sich um die „Wärmebehandlung“ der NiTi-Feile, die bereits ihre finale Form aufweist. Dadurch gelingt es im Idealfall, die Phasentransformationstemperatur, das heißt die Temperatur, bei der die Feile vom martensitischen in den austenitischen Zustand übergeht, auf einen Bereich oberhalb der Körpertemperatur zu verschieben (Abb. 7). Zwischen der martensitischen und der austenitischen Phase existiert noch eine Transformationsphase, die sogenannte R-Phase [38]. Der Anteil an martensitscher Phase bzw. R-Phase hat einen ganz entscheidenden Einfluss auf die Sicherheit und Flexibilität der Feilen. Je höher der martensitische Anteil ist, umso flexibler und biegsamer sind die Feilen. Darüber hinaus verfügen sie über die sogenannte „Shape-Memory“, das heißt, sie können vorgebogen werden und verbleiben dann in dieser Struktur. Dies hat ganz praktische Vorteile. So können Feilen, beispielsweise bei geringer Mundöffnung vorgebogen werden und so leichter in den Wurzelkanal eingeführt werden.
 Schlichting
Schlichting![Abb. 8: Mögliche Varianten einer Wärmebehandlung [120]](https://dentalwelt.spitta.de/wp-content/uploads/2024/05/Bild-8-1024x539.webp) Schlichting
SchlichtingZusammenfassend führen diese Eigenschaften zu einer signifikanten Steigerung der Feilensicherheit [39] und der Flexibilität [40]. Darüber hinaus folgen die Feilen besser dem ursprünglichen Kanalverlauf, arbeiten also mit weniger Dentinabtrag als frühere Generationen von NiTi-Feilen [41]. An dieser Stelle muss jedoch darauf hingewiesen werden, dass auch wärmebehandelte NiTi-Feilen sehr unterschiedliche physikalische Eigenschaften aufweisen können. Zum einen können die Verfahrensschritte einer Wärmebehandlung von Hersteller zu Hersteller sehr stark variieren (Abb. 8). So ist es möglich, über unterschiedliche Verfahrensweisen bei der Wärmebehandlung aus ein und demselben Ausgangsmaterial sehr unterschiedliche Mikrostrukturen zu schaffen (Abb. 9a und b). Diese Mikrostrukturen verfügen damit auch über sehr unterschiedliche physikalische Eigenschaften. Darüber hinaus kann auch das Feilendesign Eigenschaften wie die Frakturresistenz und Flexibilität beeinflussen. Ohne alle Aspekte zu beschreiben, sei an dieser Stelle erwähnt, dass Feilen mit geringerem Taper zu einer erhöhten Flexibilität und damit auch erhöhten Feilensicherheit beitragen [42]. Neben den Feilen an sich trägt auch die Kinematik moderner Endodontiemotoren zu einer weiteren Erhöhung der Behandlungssicherheit bei. Die beiden am häufigsten verwendeten Bewegungsmuster sind dabei die vollrotierende Bewegung und das reziproke Bewegungsmuster [43]. Daneben sind aber auch Bewegungen wie die OTR-Bewegung (Optimal Torque Reverse), die OGP 2 Motion (Optimal Glide Path) oder aber die transaxiale Bewegung zu nennen. Als Resümee lässt sich zum einen festhalten, dass durch die Wahl der passenden Feile und beispielsweise einer Kombination unterschiedlicher Bewegungsmuster die Behandlungssicherheit maximiert werden kann. Zum anderen ermöglichen geringer getaperte flexiblere Feilensysteme die sichere Aufbereitung selbst stark gekrümmter Kanalsysteme (Abb. 10). Darüber hinaus kann durch die Verwendung extrem flexibler Feilen mit geringerem Taper der ursprüngliche Kanalverlauf besser beibehalten und damit eine minimalinvasive Aufbereitung erreicht werden.
![Abb. 9a und b: Unterschiedliche Mikrostrukturen nach Wärmebehandlung [121]](https://dentalwelt.spitta.de/wp-content/uploads/2024/05/Bild-9-1024x462.webp) Schlichting
Schlichting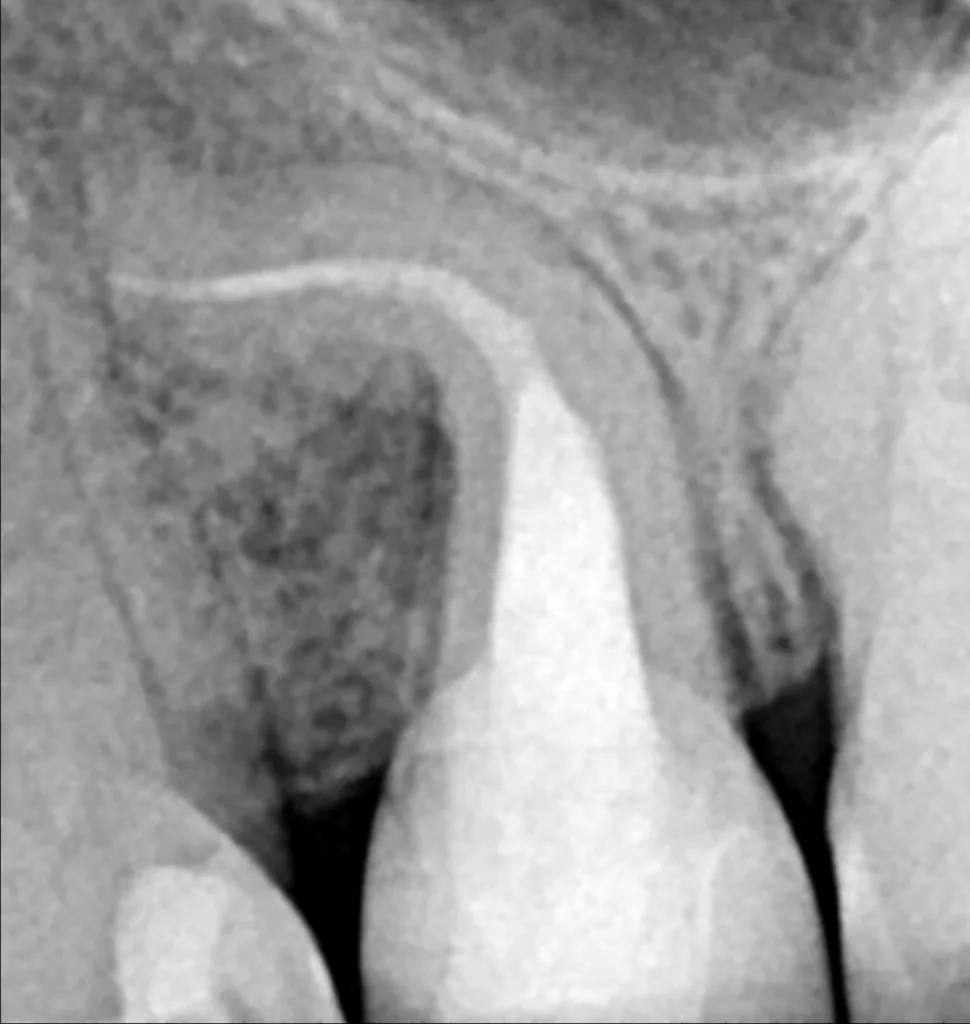 Schlichting
SchlichtingSpüllösungen: Bewährtes und Neues
Über viele Jahrzehnte stellte die Kombination von Natriumhypochlorid (NaOCl) und EDTA den Goldstandard hinsichtlich endodontischer Spüllösungen dar. Neuere Entwicklungen zielen darauf ab, unser Spülprotokoll im Sinne einer einzigen Spüllösung, bei Beibehaltung der Effektivität von NaOCl und EDTA, zu vereinfachen.
Natriumhypochlorid (NaOCl)
Umfragen belegen, dass Natriumhypochlorid weltweit die am weitesten verbreitete Spüllösung in der Endodontie darstellt [44]. In einer von der American Association of Endodontists durchgeführten Befragung gaben über 90% der Teilnehmer/-innen an, mit NaOCL zu spülen, 50% sogar mit höheren Konzentrationen als 5% [45]. Dabei verfügt NaOCl über mehrere herausragende Eigenschaften:
• NaOCl ist in der Lage, nekrotisches Gewebe aufzulösen [46]
• NaOCl ist in der Lage, die organischen Anteile des Smear Layers aufzulösen [47]
• NaOCl wirkt bakterizid gegen endodontisch relevante Bakterien
• NaOCl war die einzige Spüllösung, die künstlichen Biofilm entfernen konnte und zusätzlich bakterizid auf die im Biofilm enthaltenen Bakterien wirkte [48]
Um also die bereits mehrmals erwähnten biologischen Ziele der endodontischen Therapie zu gewährleisten, ist bis heute die Verwendung von NaOCl unabdingbar. Die „richtige“ Konzentration wird nach wie vor kontrovers diskutiert. Hinsichtlich der intrakanalären Reduktion von Mikroorganismen konnten keine signifikanten Unterschiede zwischen 0,5% und 5% Na-OCl gefunden werden [49]. Jedoch scheint die Zeit für die Auflösung von Pulpagewebe direkt von der Konzentration des NaOCl abhängig zu sein [50]. Unabhängig von der Konzentration ist das Spülvolumen ein entscheidender Aspekt für die Wirkung von NaOCl. Große Mengen an NaOCl erhöhen in jedem Fall dessen Wirksamkeit [51]. Empfohlen werden mindestens 10 ml NaOCl pro Wurzelkanal.
Eine weitere Möglichkeit, die Wirkung von NaOCl zu steigern, ist dessen Erwärmung. Eine Temperaturerhöhung führt zu einer sofortigen Steigerung des gewebslytischen Effektes [52]. Der bakterizide Effekt des NaOCl nimmt durch eine Erhöhung der Temperatur ebenfalls signifikant zu. In einem Temperaturbereich von 5 °C bis 60 °C führte jede Steigerung der Temperatur um 5 °C zu einer Verdoppelung des bakteriziden Effektes [53]. In einer In-vivo-Studie wurde der Temperaturverlauf von NaOCl bei Injektion mit Raumtemperatur und auf 60 °C erwärmtem NaOCl verglichen. Beide Lösungen hatten nach 240 Sek. die Körpertemperatur erreicht. Bedenkt man jedoch, dass in den ersten 2 Minuten der größte Teil der Chloridionen durch Reaktion mit umgebenden Strukturen bereits aufgebraucht wird, aber in dieser Zeit durch die Erwärmung eine höhere Effektivität gegeben ist, spricht vieles für eine Erwärmung des NaOCl vor Gebrauch [54]. Neben seinen vielen positiven Eigenschaften besitzt NaOCl leider auch einige weniger erfreuliche Aspekte. So kann es vor allem in höheren Konzentrationen toxisch auf vitale Gewebe wirken [55]. Es ist zudem nicht in der Lage, den Smear Layer zu entfernen und wirkt korrosiv auf endodontische Instrumente. Wenn NaOCl als finale Spülung verwendet wird, kann ferner die Haftung von Sealern zur Wurzelkanalwand negativ beeinflusst werden [56].
Chelatoren
Auch wenn NaOCl die bis heute wichtigste Spüllösung in der endodontischen Therapie darstellt, kann es keine anorganischen Dentinanteile auflösen und somit nicht die Bildung von Smear Layer während der Instrumentierung der Wurzelkanäle verhindern [57]. Daneben behindern Kalzifikationen immer wieder die vollständige Instrumentierung des Wurzelkanalsystems. Aus diesen Gründen werden demineralisierende Agentien wie Ethylendiamin Tetra Acetat (EDTA) [58] oder aber Zitronensäure [59] als supplementäre Spülungen empfohlen. Chelatoren wie EDTA oder Zitronensäure sind in der Lage, den Smear Layer effektiv zuentfernen. Normalerweise wird EDTA in Konzentrationen von 17% verwendet, wobei eine Einwirkzeit von 1 Minute zu einer vollständigen Entfernung der Schmierschicht führt [60] (Abb. 11). Obwohl Zitronensäure eine leicht effektivere Wirkung als EDTA zugeschrieben wird, gelingt die Entfernung von Smear Layer mit beiden Substanzen sehr verlässlich [61]. Dieser Effekt ist deswegen so wichtig, da erst nach Entfernung der Schmierschicht antimikrobielle Agentien wie etwa NaOCl ihre Effektivität auch tief in den Dentintubuli entfalten können. Zusätzlich wird sowohl EDTA als auch Zitronensäure eine Rolle bei der Elimination von Biofilm zugeschrieben [62]. Da es durch EDTA zu einer Dekalzifizierung und damit Erweichung des Dentins kommt, sollten hier ein übermäßiges Spülvolumen und zu lange Einwirkzeiten vermieden werden [63]. EDTA gewinnt zudem an Bedeutung durch Wirksamkeit gegen Pilze wie Candida albicans [64]. Dieser Effekt wurde für Zitronensäure bisher noch nicht nachgewiesen.
![Abb. 11: Freie Dentintubuli nach chemomechanischer Desinfektion [122].](https://dentalwelt.spitta.de/wp-content/uploads/2024/05/Bild-11-1024x942.webp) Schlichting
Schlichting1-Hydroxyethylen Disphosponat (HEDP)
Etidronsäure (1‐hydroxyethane 1,1‐diphosphonic acid, HEDP) ist eine chemische Verbindung aus der Gruppe der Bisphosphonate. Es wird für die Behandlung von Osteoporose und Morbus Paget verwendet. In der Endodontie findet HEDP seit einigen Jahren als Mischung mit NaOCl Verwendung und ist unter dem Handelsnamen DualRinse® erhältlich. HEDP liegt in Pulverform vor und wird direkt vor Behandlungsbeginn mit NaOCl zu einer farblosen Flüssigkeit vermischt. Dabei wird über einen Zeitraum von ca. 1 Stunde die antimikrobielle und gewebslösende Eigenschaft des NaOCl nicht verändert und zusätzlich über das HEDP eine Komponente zugefügt, die die Entstehung von Smear Layer verhindert [65]. Aus klinischer Sicht führt die Kombination der positiven Eigenschaften von NaOCl und EDTA in einer einzigen Spüllösung zu einer starken Vereinfachung des Spülprotokolls. Dabei werden die Eigenschaften von NaOCl nach Mischung mit HEDP nicht beeinflusst [66]. Zusätzlich verhindert die Kombination von HEDP und NaOCl die Bildung von Debris und die Entstehung von Smear Layer bei der Instrumentierung [67]. Es konnte zudem gezeigt werden, dass HEDP in Verbindung mit NaOCl eine bessere antibakterielle Wirkung aufweist als die Kombination von NaOCl mit Zitronensäure [68]. In einer weiteren Studie wurde eine deutliche Zunahme der Anzahl bakterienfreier Dentintubuli bei Verwendung der Kombination von NaOCL und HEDP verglichen zu NaOCl und EDTA nachgewiesen [69]. Ein weiterer wichtiger klinischer Vorteil von HEDP gegenüber EDTA ist die weniger aggressive Wirkung auf die Dentinoberfläche [70]. In einer bisher unveröffentlichten Studie konnten keine negativen Auswirkungen hinsichtlich Zytoxizität oder Genotoxizität durch die Mischung beider Substanzen festgestellt werden [71].
Biopure MTAD, Tetraclean und TRITON
Bei Biopure und MTAD-Substanzen handelt es sich um eine Mischung aus Antibiotika,einem Chelator wie Zitronensäure und einem Waschmittel. Durch diese Mischung sollen beide Substanzen in der Lage sein, sowohl organisches Material aufzulösen als auch den Smear Layer zu entfernen [72]. MTAD ist eine wässrige Lösung aus 3% Doxycyclin, einem Breitbandantibiotikum, 4,25% Zitronensäure sowie 0,5% Polysorbate 80 Detergens (Tween 80). Es wird direkt vor Anwendung aus einer Flüssigkeit und einem Pulver zusammengemischt [73]. Tetraclean ist auch ein Kombinationspräparat. Es enthält ebenso wie MTDA Doxycyclin als Breitbandantibiotikum, jedoch in geringerer Dosierung (150 mg/5 ml für MTAD und 50 mg/5 ml für Tetraclean). Anstatt Tween 80 ist Tetraclean Polypropylenglykol als Reinigungsmittelzugesetzt. Tetracycline wirken bakteriostatisch, können jedoch in höheren Konzentrationen auch bakterizid wirken. Es wird vermutet, dass die Kombination der Präparate einen synergistischen Effekt auf die Zerstörung der Bakterienzellwände haben könnte. Die Studienlage zur antibakteriellen Wirksamkeit ist jedoch uneinheitlich. Frühe In-vitro-Studien zeigten eine bessere antibakterielle Wirkung als traditionelle Spüllösungen [74], in anderen Studien wurde hingegen eine verbesserte antibakterielle Wirkung von 5,25% NaOCl verglichen mit MTAD nachgewiesen [75]. Hinsichtlich der Entfernung der Schmierschicht war die Wirkung von MTAD mit EDTA vergleichbar [76]. Die wenigen für Tetraclean vorliegenden Studien kommen zu ähnlichen Ergebnissen. Ein weiteres Kombinationspräparat mit NaOCl wurde unter dem Handelsnamen TRITON auf den Markt gebracht. Erste Studienergebnisse waren recht positiv [77], jedoch müssen hier noch weitere Studien folgen und abgewartet werden.
Noch gründlichere Reinigung: die Aktivierung der Spüllösungen
Eine weitere Verbesserung der Wirkung von Desinfektionslösungen kann durch deren Aktivierung, das heißt durch die Übertragung von physikalischer Energie auf die Flüssigkeit erzielt werden. Aus einer Vielzahl unterschiedlicher Möglichkeiten gehören die Ultraschallaktivierung (27 bis 33 kHz), die Schallaktivierung (> 20 kHz) [78] und die Aktivierung mittels Laserenergie [79] zu den heute wichtigsten und am weitesten verbreiteten Methoden.
Passive Ultraschallaktivierung (PUI)
Unter passiver ultraschallaktivierter Spülung (passive ultrasonic activation, PUI) versteht man das Einbringen einer speziellen, in der Regel aus Stahl gefertigten Ultraschallfeile in den mit Spülflüssigkeit gefluteten Wurzelkanal [80]. Diese Übertragung der extrem schnellen Schwingungen der Feile auf die umgebende Flüssigkeit führt zu akustischen Strömungsphänomenen (Microstreaming und Kavitation). Beide physikalischen Effekte können zur Zerstörung des Biofilms beitragen sowie die Penetration der Spüllösungen in die Dentintubuli verbessern [81] Daneben kommt es bei der Aktivierung der Spülflüssigkeit zu deren Erwärmung, was – wie bereits oben beschrieben – die Effektivität der Spüllösung steigern kann. Es konnte gezeigt werden, dass der Einsatz von PUI die Reinigungswirkung von Spüllösungen in komplexen Kanalanatomien stark verbessert [82]. Des Weiteren haben Untersuchungen den Nachweis erbracht, dass PUI deutlich zur Entfernung von Biofilm auf Kanalwänden beitragen kann [83].
Die Schallaktivierung
Bei Oszillationsbewegungen im Frequenzbereich von 20 Hz bis 20000 Hz spricht man von Schallaktivierung. Im Prinzip handelt es sich hierbei immer um flexible Polymerspitzen, die sich im Design etwas unterscheiden. Der größte Unterschied zur Ultraschallaktivierung liegt im Frequenzbereich, mit welchem die jeweiligen Tips betrieben werden. So wurde der Frequenzbereich, in dem der EndoActivator® arbeitet, mit 160 Hz, 175 Hz und 190 Hzangegeben [84]. Eine neuere Entwicklung stellt die sogenannte EDDY-Spitze dar. Dabei oszilliert eine Polyamidspitze in einer dreidimensionalen Bewegung in einem Frequenzbereich von 5000 Hz bis 6000 Hz. Die entstehenden Verwirbelungen der Spülflüssigkeit werden im Englischen als „EDDY“ bezeichnet, woraus auch der Produktname abgeleitet wurde. MM 1500 ist ein weiterer Vertreter der Gruppe von Ansätzen, die wie EDDY auf einen Air Scaler geschraubt werden und dann Frequenzen bis 1500 Hz generieren können. Die Studienlage ist wie bei der PUI relativ heterogen. In einigen Studien wurde die Schallaktivierung als genauso effektiv wie PUI bewertet [85], andere kamen zu dem Schluss, dass schallaktivierte Spülung verglichen mit PUI weniger effektiv sei [86]. In einer weiteren Studie, die die Fähigkeit zur verbesserten Entfernung organischen Gewebes bei Aktivierung mit Schall oder Ultraschall verglich, konnten ebenfalls keine signifikanten Unterschiede zwischen den Aktivierungsmethoden festgestellt werden [87].
Die Laseraktivierung von Spülflüssigkeiten (LAI)
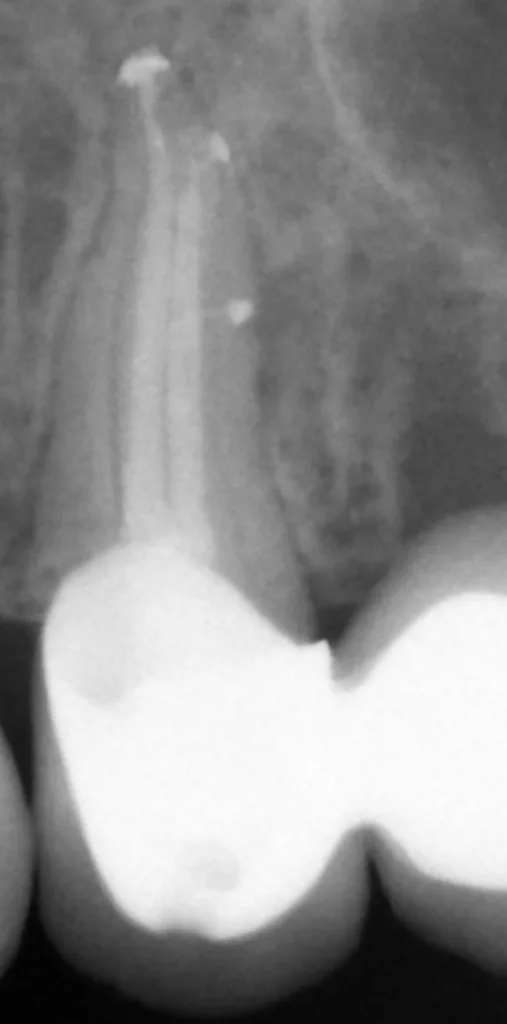 Schlichting
SchlichtingBei der LAI wird Laserenergie durch Absorption in Spülflüssigkeiten in physikalische Energie überführt, die über mehrere Effekte zur Reinigung komplexer Kanalsysteme beiträgt. Blanken und Verdaasdonk beschrieben erstmalig die Auswirkungen von Laserstrahlung in Spülflüssigkeiten [88]. Sie verwendeten einen Er,Cr:YSGG (ErbiumChromium-Yttrium-Scandium-Garnett) Laser und registrierten eine sofortige rapide Flüssigkeitsbewegung bei jedemLaserpuls. Daneben beobachteten sie die Entstehung kleiner Gasbläschen, sogenannter „Bubbles“, und von Kavitationseffekten. Dadurch kommt es zu ausgeprägten Reinigungseffekten sowohl im Hauptkanal aber auch in Isthmen, lateralen Kanälen (Abb. 12) und bis weit in die Dentintubuli. So wurde in einer erst kürzlich veröffentlichten Studie die Eindringtiefe von NaOCl in Dentintubuli bei verschiedenen Aktivierungsmethoden beschrieben.
Bei der hier verwendeten Laseraktivierung handelte es sich um eine Sonderform (PIPS), bei welcher der Lasertip lediglich ins geflutete Pulpenkammerkavum eingebracht wurde. Im apikalen Drittel zeigten sich dabei signifikant höhere Eindringtiefen bei LAI als mit allen anderen Methoden [89]. Sowohl mit NaOCL als auch EDTA konnte eine fast vollständige Elimination von Bakterien und Smear layer sowie Biofilm im Invitro-Experiment nachgewiesen werden [90]. Dabei kam es zu keinerlei Hinweis der Extrusion von Spülflüssigkeiten [91]. Eine Weiterentwicklung von PIPS stellt SWEEPS dar, bei dem die Frequenz und Anzahl der Laserimpulse gesteigert wurden. Eine aktuell veröffentlichte Studie zeigte ebenfalls eine signifikant bessere Entfernung von artifiziellem Biofilm aus simulierten lateralen Kanälen mit LAI als mit allen anderen Aktivationstechniken [92]. In einer Literaturübersicht hat die Mehrheit der publizierten Studien ebenfalls positive Ergebnisse für die Verwendung von LAI nachweisen können [93].
Kalziumsilikatbasierte Sealer (CSBS): eine neue Ära
Als hydraulische Zemente wird eine Gruppe von Materialien bezeichnet, welche in Kontakt mit Wasser hydratisiert und zusätzlich mit anderen vorhandenen Flüssigkeiten reagieren kann [94]. Generell können hydraulische Zemente in der Endodontie für unterschiedliche Aufgaben eingesetzt werden, wie den Verschluss von Perforationen, den Verschluss weit offener apikaler Regionen, die direkte Pulpaüberkappung oder aber als endodontische Sealer. Um zur Gruppe der hydraulischen Zemente gerechnet zu werden, muss die 1. Reaktion eine Hydratationsreaktion sein. Deshalb werden kunststoffmodifizerte Materialien nicht zu dieser Stoffgruppe gerechnet [95]. Momentan können 2 Arten von CSBS unterschieden werden. Zum einen Sealer, bei denen Pulver und Flüssigkeit vor Gebrauch miteinander vermischt werden müssen. Hier wird die Hydratationsreaktion beim Anmischvorgang initiiert, also vor Einbringen des Sealers in den Wurzelkanal [96]. Eine weitere Darreichungsform stellen sogenannte „ready to use“ Sealer dar. Hier erfolgt das Anmischen in Mischkartuschen und die Hydratationsreaktion läuft erst nach Einbringen des Sealers in den Wurzelkanal ab. Die benötigte Feuchtigkeit wird hierbei vor allem aus den Dentintubuli gewonnen [97].
Bei der Abbindereaktion von CSBS-Sealern kommt es zur Ausfällung von Kalziumhydroxid (CaOH2), Hydroxylapatit [98] sowie von Kalziumphosphat. Kalziumphosphat kann zur Neubildung von Gewebe anregen und hat damit bioaktives Potential [99]. So konnte gezeigt werden, dass CSBS den Zellmetabolismus positiv beeinflussen [100]. Verglichen mit AH Plus scheint die Osteoneogenese durch CSBS signifikant gesteigert zu werden [101]. Eine weitere Studie zeigte bei Kontakt von menschlichen Stammzellen mit CSBS eine Differenzierung in osteoblastenähnliche Zellen [102]. Im Vergleich zu AH Plus wiesen CSBS eine geringere Zytotoxizität auf [103]. Ihre antibakteriellen Eigenschaften waren gegenüber AH Plus signifikant verbessert und mit denen von MTA vergleichbar [104]. Ein weiterer nennenswerter Unterschied zwischen modernen CSBS und AH Plus ist die charakteristische langandauernde antibakterielle Wirksamkeit, welche über mehrere Wochen erhalten bleibt, während sie bei AH Plus bereits nach einigen Stunden wieder abnimmt [105]. Für die Löslichkeit von CSBS gibt es höchst unterschiedliche Angaben. Dies scheint jedoch eher mit sehr differenzierten Studiendesigns zusammen zu hängen [106]. Die gegenüber anderen Sealern erhöhte Löslichkeit ist sogar Voraussetzung für das bioaktive Potential dieser neuartigen Sealergruppe. Nur so kann es zur Freisetzung der oben genannten Substanzen kommen [107]. Ein Vorteil ist zudem die leichte Expansion von CSBS verglichen mit allen anderen Sealertypen [108].
Die genannten positiven Eigenschaften dieser neuartigen Stoffgruppe haben zu einem Paradigmenwechsel hinsichtlich der Funktion der Sealer und der Wurzelfüllung geführt. Sollte bei Verwendung des langjährigen Goldstandards AH Plus und warmer Guttapercha ein möglichst hermetisch dichter Verschluss aller Hohlräume erzielt werden, hat sich heute der Fokus zu einer bioaktiven Wurzelfüllung, bei welcher der Körper aktiv zur Heilung angeregt wird, verschoben. Hiermit ergeben sich auch neue, deutlich weniger techniksensitive Möglichkeiten zur Wurzelfüllung. Wegen der Schrumpfung herkömmlicher Sealer wie zum Beispiel AH Plus [109] war bisher immer das Bestreben, die Sealer-Menge zu minimieren und die Menge an Guttapercha zu maximieren. Hierbei wurde die Guttapercha erwärmt und mithilfe von hydrostatischem Druck in alle Hohlräume gepresst. Dieses als warme vertikale Kompaktion bezeichnete Verfahren galt über viele Jahre als Goldstandard [110].
Aufgrund der Materialeigenschaften von CSBS ist eine neuartige Fülltechnik, die sogenannte „CSBS Single Cone technique“ entstanden [111]. Hierbei wird der Wurzelkanal relativ großzügig mit CSBS gefüllt. Dies kann beispielsweise mithilfe eines Lentulos oder aber durch Injektion des Selaers in den vorbereiteten Kanal erfolgen. Nun wird ein einzelner Guttaperchastift, dessen Dimension kleiner als die zuletzt verwendete Feile sein sollte, unter leicht pumpenden Bewegungen in den Wurzelkanal eingebracht. Durch den sehr geringen lateralen Druck soll der CSBS in alle Kanalunregelmässigkeiten gepresst werden. Der Cone wird koronal abgetrennt und leicht nach apikal kompaktiert. Im Unterschied zu den bisher gebräuchlichen Fülltechniken ist bei dieser Fülltechnik der Sealeranteil hoch, während der Guttaperchaanteil möglichst klein gehalten werden sollte (Abb. 13). Diese Technik hat gegenüber dem bisherigen Goldstandard große Vorteile. Sie ist einfach umzusetzen und wenig techniksensitiv. Darüber hinaus punktet das Verfahren mit geringem Zeitaufwand und hoher Effektivität. Verglichen mit der warmen vertikalen Kompaktion ergibt sich ein weiterer wichtiger Vorteil. Um die jeweils passenden Instrumente (Heat Plugger, Plugger etc.) tief genug in den Wurzelkanal einbringen zu können und eine Widerstandsform gegen das Überpressen von Guttapercha zu bilden, musste der Kanal bisher einen entsprechenden „Mindesttaper“ aufweisen. Dieser wurde häufig mit 7% angegeben [112]. Durch die CSBS Single Cone Technique wird ein geringerer Taper der Aufbereitung ermöglicht, da keine Instrumente so tief in den Wurzelkanal eingebracht werden müssen und keine Gefahr der Überpressung warmer Guttapercha besteht (Abb. 14). In Studien konnte bei der Verwendung einer CSBS Single Cone Technique eine vergleichbare Erfolgsquote wie beim bisherigen Goldstandard, der warmen vertikalen Kompaktion, nachgewiesen werden [113,114]. Auch eine erst kürzlich veröffentlichte Studie zeigte vergleichbare Erfolgsraten [115].
![Abb. 13: CSBS Single Cone Technique [123]](https://dentalwelt.spitta.de/wp-content/uploads/2024/05/Bild-13-1024x447.webp) Schlichting
Schlichting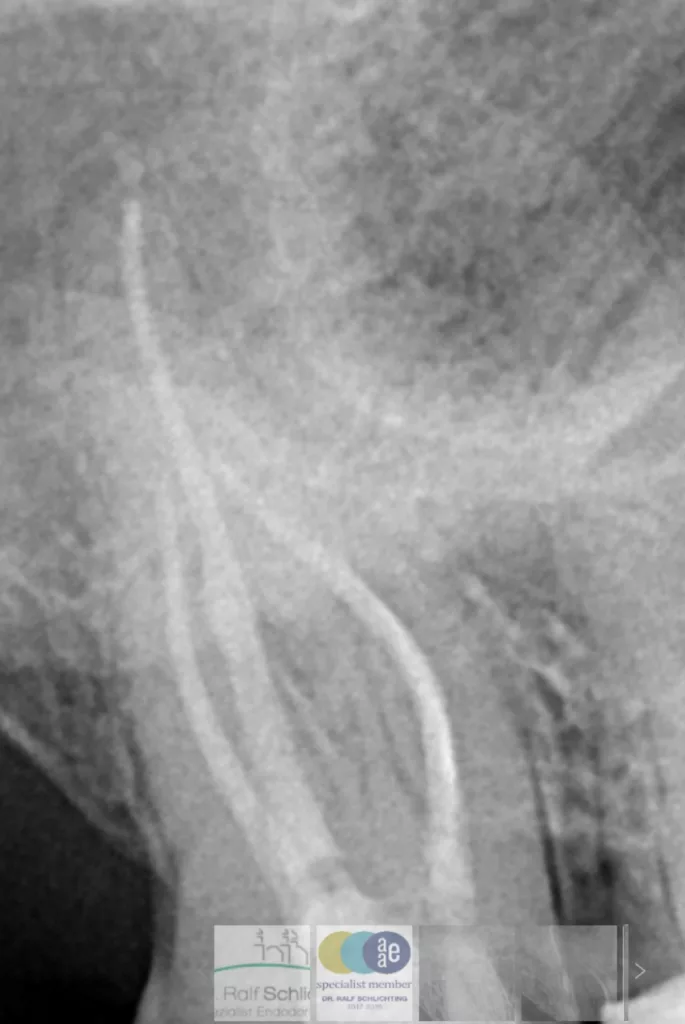 Schlichting
SchlichtingFazit
Die endodontische Therapie des Wurzelkanalsystems stellt uns Behandler/-innen vor große Herausforderungen. Neben profundem theoretischem Wissen und Erfahrung ist es der Einsatz moderner Instrumente, Materialien und Techniken, der uns die tägliche Arbeit erleichtert, eine substanzschonende Therapie ermöglicht und somit die Erfolgswahrscheinlichkeit erhöht. Um die Stabilität des behandelten Zahnes zu gewährleisten, sollte möglichst viel natürliche Zahnsubstanz erhalten werden, ohne jedoch die biologischen Ziele der endodontischen Therapie zu gefährden. Durch die Kombination zahlreicher moderner Verfahren und Hilfsmittel lassen sich heute beide Ziele in vielen Fällen sehr gut miteinander vereinbaren.
 Entdecke CME Artikel
Entdecke CME Artikel  Entdecke Artikel mit Download
Entdecke Artikel mit Download 
![Interindividuelle Diversität endodontischer Infektionen [116]](https://dentalwelt.spitta.de/wp-content/uploads/2024/05/Bild-1-jpg.webp)

 Mit Google einloggen
Mit Google einloggen
 Mit Facebook einloggen
Mit Facebook einloggen
Keine Kommentare.