Der Begriff „Halitosis“ ist ein Zusammenschluss des lateinischen Wortes „Halitus“ (Atem) und des griechischen Suffixes „-osis“ (Erkrankung). Die Bibel, wie auch andere religiöse Schriften, berichten schon früh darüber. So bedauert Hiob (Hiob 19:17): „Mein schlechter Atem ist für meine Frau unerträglich.“ Vor beinahe 2.000 Jahren annullierten jüdische Männer ihre Ehe (Ketuba), wenn sie entdeckten, dass ihre Frau an schlechtem Atem litt. Islamische Theologen betonen die Bedeutung des Miswaks (ein Hilfsmittel zur Mundsäuberung) und empfehlen dessen Gebrauch während des Ramadans, um Halitosis zu vermeiden [23].
Zum ersten Mal wurde Halitosis in einer wissenschaftlichen Publikation von J.W. Howe im Jahr 1874 erwähnt. Derzeit gibt es für Halitosis in der wissenschaftlichen Literatur verschiedene Begriffe: schlechter Atem, Mundgeruch, oraler Malodor, F(o)etor ex ore, Stomatodysodia etc. In unserer Gesellschaft ist dieses Problem noch immer ein großes Tabuthema, unter dem mehr Männer als Frauen leiden und mehr ältere als jüngere Menschen [37]. In den USA ist das Geschäft mit dem Überdecken des Mundgeruchs mit Kaugummi, Pfefferminz und Mundspüllösungen zu einem Milliardengeschäft geworden, ohne dabei das eigentliche Problem zu lösen [22].
Mundhöhle oder HNO-Bereich ursächlich
Die Mundhöhle ist mit 85% die prominenteste Quelle von schlechtem Atem [35] (Tab. 1, Abb. 1a u. b [30]). Des Weiteren ist der HNO-Bereich in 10% der Fälle von Malodor involviert (Tab. 2, Abb. 2a u. b [12]). Letztendlich können auch einige systemische Erkrankungen Ursache für unangenehmen Atem sein [18]. In der Tabelle 3 sind die wichtigsten systemischen Erkrankungen genannt, die mit Halitosis in Verbindung stehen. Magenprobleme, die von vielen noch immer als Hauptursache für schlechten Atem gehalten werden, sind tatsächlich die wirklich sehr seltene Ursache von Mundgeruch (< 0,5% der Fälle). Abbildung 3 zeigt die Lokalisation eines Zenker-Divertikels, das auch für Foetor ex ore ursächlich sein kann. Prof. Dr. Curd Bollen
Prof. Dr. Curd Bollen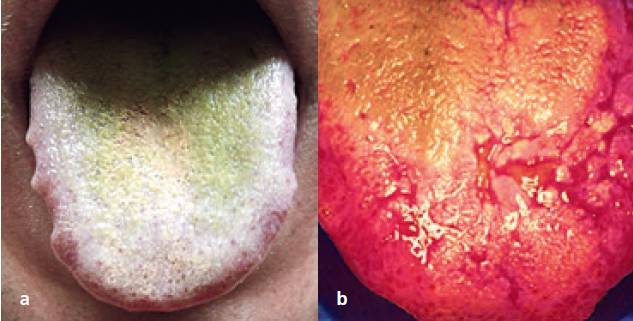 Prof. Dr. Curd Bollen
Prof. Dr. Curd Bollen Prof. Dr. Curd Bollen
Prof. Dr. Curd Bollen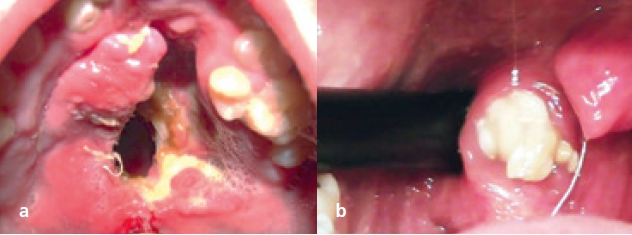 Prof. Dr. Curd Bollen
Prof. Dr. Curd Bollen Prof. Dr. Curd Bollen
Prof. Dr. Curd Bollen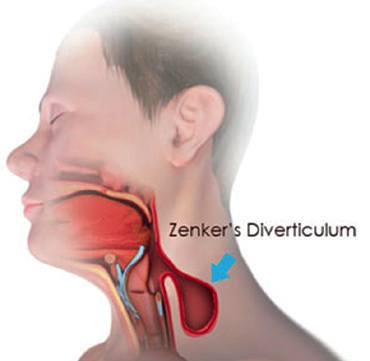 Prof. Dr. Curd Bollen
Prof. Dr. Curd Bollen![Abb. 4: Bakterieller Abbau, der zu schlechtem Atem führt [34].](https://dentalwelt.spitta.de/wp-content/uploads/post_images/Abb.07_366.jpg.webp) Prof. Dr. Curd Bollen
Prof. Dr. Curd Bollen
In der Mundhöhle sind orale Bakterien, Spezies ähnlich zu den Pathogenen, die bei Parodontitis und Gingivitis vorkommen, für die Produktion von Mundgeruch verantwortlich (z.B. Porphyromonas gingivalis, Fusobacterium nucleatum, Spirochäten, Prevotella- Spezies etc.) [16]. Diese Bakterien treten an drei Orten in der Mundhöhle auf: interdental, in parodontalen Taschen und auf dem Zungenrücken, d.h. auf einer Oberfläche von beinahe 25 cm2. Diese Lebensräume weisen eine hohe Humidität, hohe Temperaturen und Sättigung mit Nährstoffen auf (z.B. Essensreste, abgeschilferte Zellen, Speichel). Dies führt zu einem anaeroben Abbau der verfügbaren Proteine und weiterhin zur Produktion von anaerobem, faulem Odor (fötidem Geruch). Abbildung 4 beschreibt den anaeroben intraoralen Prozess [34].
Mundgeruch professionell testen
Mundgeruch kann, wie in der Literatur beschrieben [4], auf unterschiedliche Art und Weise getestet und bewertet werden.
1. Selbstbewertung
Patienten können ihren schlechten Atem selbst feststellen durch: (a) Handgelenk-Leck-Test (an dem am Handgelenk getrockneten Speichel riechen); (b) Zahnseide-Test (an benutzter Zahnseide riechen); (c) Löffel-Test (an einem Löffel riechen, mit dem der Zungenrücken abgekratzt wurde). Allerdings sollte man bedenken, dass es sehr schwer ist, die eigene Halitosis wahrzunehmen.
2. Organoleptischer Test
Gut ausgebildete Mitarbeiter riechen an einer Probe. Eine Bewertung von 0 (kein wahrnehmbarer Geruch) bis 5 (extrem fauler Odor) wird den Proben zugeordnet [29]. Die unterschiedlichen Bewertungsmöglichkeiten sind in Tabelle 4 aufgelistet [4]. Abbildung 5 zeigt die organoleptische Bewertung von ausgeatmeter Luft des Patienten. Prof. Dr. Curd Bollen
Prof. Dr. Curd Bollen Prof. Dr. Curd Bollen
Prof. Dr. Curd Bollen
3. Mechanischer Test
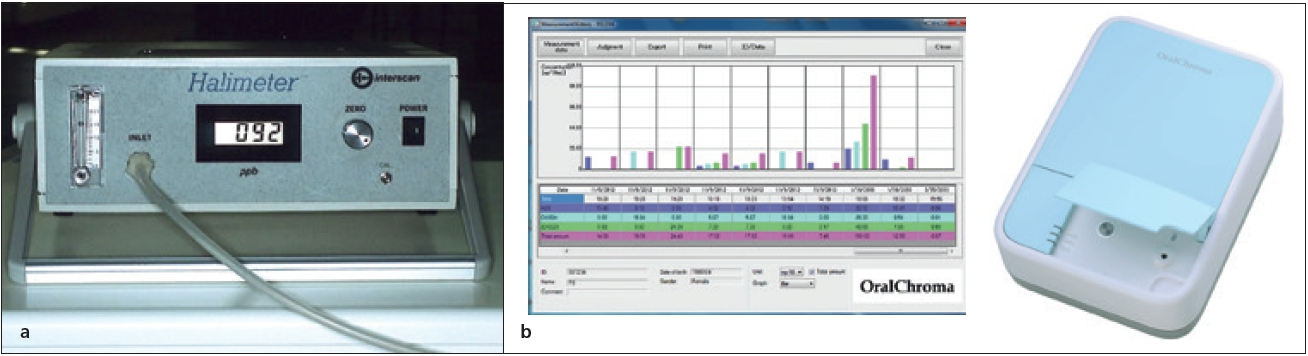 Prof. Dr. Curd Bollen
Prof. Dr. Curd Bollen
Implantate und Halitosis:
Kein gutes Zeichen für die Mundgesundheit
Genau wie eigene Zähne oder andere Restaurationen können Implantate zu Halitosis beitragen. Im Folgenden werden Verbindungen aufgezeigt und Empfehlungen für die Praxis zur Vermeidung dieser Probleme gegeben. In manchen Fällen ist der Geruch auch Hinweis auf schwerwiegende Komplikationen.
Parodontitis oder Gingivitis bei partiell zahnlosen Patienten
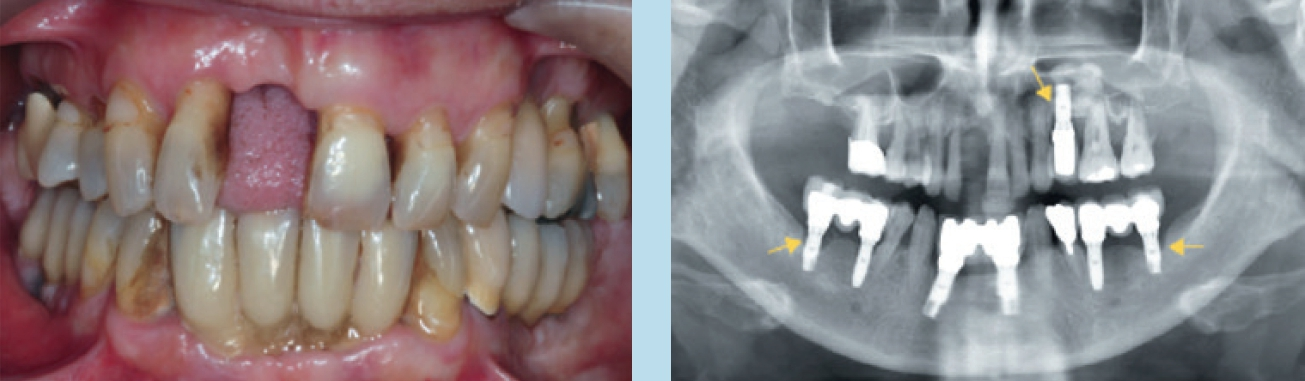 Prof. Dr. Curd Bollen
Prof. Dr. Curd Bollen
Periimplantitis und periimplantäre Mukositis
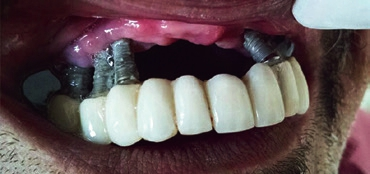 Prof. Dr. Curd Bollen
Prof. Dr. Curd Bollen
Mundhygiene
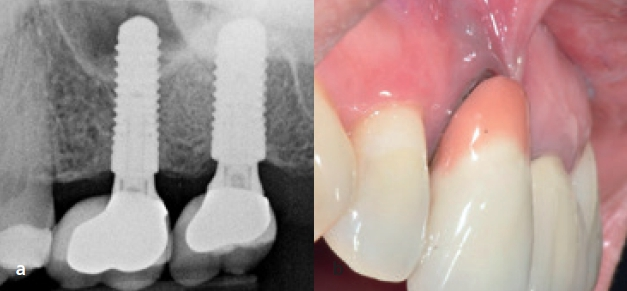 Prof. Dr. Curd Bollen
Prof. Dr. Curd Bollen
Mikrospalten
 Prof. Dr. Curd Bollen
Prof. Dr. Curd Bollen
Makrospalten
Sowohl Mikrospalten als auch Makrospalten können durch eine falsche Position der Krone auf dem Implantat oder aufgrund inkorrekter Anfertigung der Krone im Labor entstehen. Dem liegt häufig eine ungenügende Abdrucknahme zugrunde. Daher ist es ratsam, immer die Passgenauigkeit des Abdruckstiftes und den Kronenrandschluss nach Verschrauben auf dem Implantat radiologisch zu kontrollieren [20].
Lockerung einer Krone oder eines Aufbaus
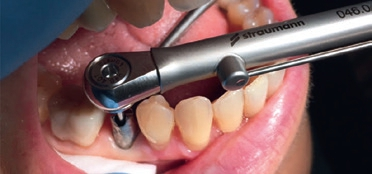 Prof. Dr. Curd Bollen
Prof. Dr. Curd Bollen
Es sollte also ein Torqueschlüssel zum Einsatz kommen; vorzugsweise ein automatischer Schlüssel, der den exakten vorgeschriebenen Torque nutzt. Verwendet man einteilige Implantate ist eine Lockerung des Aufbaus irrelevant. Einige Zirkonsysteme machen z.B. Gebrauch von Interlock, um eine Lockerung der internen Carbonschraube zu verhindern.
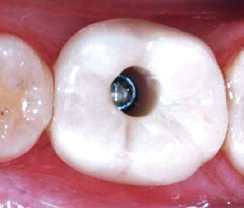 Prof. Dr. Curd Bollen
Prof. Dr. Curd Bollen
Candidainfektionen …
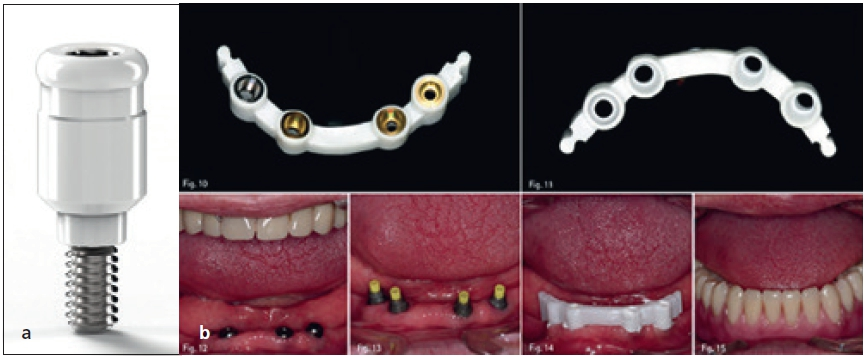 Prof. Dr. Curd Bollen
Prof. Dr. Curd Bollen
Postoperative Infektionen Jede Infektion verursacht einen typischen putriden Geruch. Besonders postoperative Infektionen riechen sehr penetrant. Dies tritt bei Implantationen auf, bei denen das Implantat nicht ossär integriert oder eine Nahtdehiszenz entstanden ist [8] (Abb. 14). Ebenso verursacht eine Infektion eines Knochenaufbaus oder Sinuslifts einen Malodor [3]. Letztendlich kann die Verwendung von Zygoma-Implantaten zu Perforationen führen, mit daraus resultierenden Infektionen und schlechtem Geruch [10]. Eine Titanallergie kann ein Phänomen hierfür sein (Abb. 15). Die Weichgewebssensitivität bedeutet eine inflammatorische Reaktion, die zur Ausschüttung von inflammatorischen Botenstoffen und zum spezifischen Geruch führt [21]. Zirkonallergien sind bisher in der wissenschaftlichen Literatur nicht beschrieben und können so auch keine inflammatorische Reaktion auslösen. Zirkon kann ein Material der Wahl für Patienten mit nachgewiesener Titanallergie sein [15].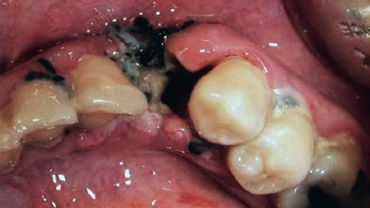 Prof. Dr. Curd Bollen
Prof. Dr. Curd Bollen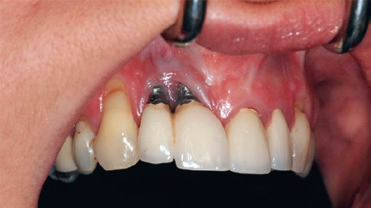 Prof. Dr. Curd Bollen
Prof. Dr. Curd Bollen
Fazit
Halitosis ist ein Problem, das in engem Zusammenhang mit der Mundhöhle steht. Da gegenwärtig mehr und mehr Patienten mindestens ein oder mehr Zahnimplantate besitzen, ist nicht mehr von der Hand zu weisen, dass diese potenziell eine relevante Bedeutung zur Entstehung von Malodor haben können. Schwefelproduzierende (pathogene) Bakterien lassen Mundgeruch entstehen; somit ist die Mundhygiene stets der prominenteste Einflussfaktor. Ein weiterer Grund können pathogene Bakterien sein, die auch die Entstehung von Gingivitis, Parodontitis und Periimplantitis verursachen. Aber auch die Beschaffenheit der Implantatsysteme und eine präzise Arbeitsweise sind von Bedeutung, um Nischen für eine Bakterienbesiedelung zu vermeiden. Wenn Herstellerangaben missachtet werden oder minderwertige Laborarbeiten zum Einsatz kommen oder eine sorgfältige Endkontrolle vergessen wird, führt dies zwangsläufig zu einem inakzeptablen Resultat, welches zu vielfältigen Problemen führt und ein Auftreten von Halitosis begünstigt. Aktuelle Studien legen nahe, dass das starke Auftreten von Periimplantitis bei Titanimplantaten als Fremdkörperreaktion gegen Titan gedeutet werden könnte [9]. Bei Zirkon wurde über eine derartige Fremdkörperreaktion noch nicht berichtet – auch nicht in der orthopädischen Chirurgie [14]. Zusammengefasst kann gesagt werden, dass auch Titanimplantate ebenfalls Mundgeruch verursachen können. Zirkonimplantate tragen weniger zur Produktion und Freisetzung von Schwefelverbindungen bei. Deshalb sollten Zirkonimplantate vermehrt bei der Rehabilitation von (teilweise) zahnlosen Patienten eingesetzt werden.
Näheres zu den Autoren des Fachbeitrages: Prof. Dr. Curd Bollen, Dr. Octavia WinklerBildquellen sofern nicht anders deklariert: Unternehmen, Quelle oder Autor/-in des Artikels
 Entdecke CME Artikel
Entdecke CME Artikel  Entdecke Artikel mit Download
Entdecke Artikel mit Download 


![Abb. 1: Vergleich der Morphologie an Implantat und Zahn (modifiziert nach [17]).](https://dentalwelt.spitta.de/wp-content/uploads/post_images/Art_Diagnostik___BFM_in_der_UIT_Abbildungen-2.webp.webp)
 Mit Google einloggen
Mit Google einloggen
 Mit Facebook einloggen
Mit Facebook einloggen
Keine Kommentare.