- Teil 1
- Fallvorstellung
- Allgemeinmedizinische Anamnese und Tabakkonsum
- Zahnmedizinische Anamnese
- Extraorale und intraorale Befunde
- Dentaler Befund
- Parodontaler Befund
- Radiologischer Befund
- Diagnosen
- Prognose
- Therapieziel und Prognose der gesamten Behandlung
- Behandlungsablauf
- Systemische Phase (Stufe 1)
- Hygienephase mit Reevaluation (Stufe 2)
- Korrektive Phase (Stufe 3)
- Unterstützende parodontale Therapie (Stufe 4)
- Schlussbetrachtung
- Teil 2
- Therapeutische Überlegungen
- Antibiotika
- Bisphosphonat-Therapie
- Gerinnungshemmende Medikation
- Vitamin D
- Kardiovaskuläre Erkrankungen
- Alkoholismus und Angststörung
- Tabakkonsum
- Zusammenfassung
Teil 1
Der demographische Wandel führt in Deutschland zu einer immer älter werdenden Bevölkerung. Die Gründe hierfür sind in erster Linie eine niedrigere Geburtenrate und eine veränderte Mortalität. Die durchschnittliche Lebenserwartung hat sich seit mehreren Jahren deutlich erhöht und beträgt bei Frauen aktuell etwa 83 Jahre.
Männer leben etwas kürzer und werden im Mittel etwa 78 Jahre alt. Viele Patienten leiden im höheren Alter an mehreren Erkrankungen – die Multimorbidität nimmt deutlich zu. In der Therapie werden oft verschiedene Medikamente verabreicht.
Es kommt zu einer Polymedikation: Eine Patientin oder ein Patient nimmt gleichzeitig verschiedene Medikamente dauerhaft ein. Je nach Begriffsbestimmung sind dies mehr als 3 bis 5 unterschiedliche Arzneimittel, die gleichzeitig verabreicht werden. Neben dem eigentlichen therapeutischen Ziel der jeweiligen Medikation können die Wirkstoffe der einzelnen Produkte miteinander interagieren oder die Behandlung einer anderen Erkrankung beeinflussen.
In manchen Fällen kommt es dabei zu zusätzlichen unerwünschten Nebenwirkungen. Die medizinische wie auch die zahnmedizinische Versorgung stehen damit vor großen Herausforderungen. Am Beispiel eines realen Patientenfalls werden in diesem Beitrag einige daraus resultierende Aspekte diskutiert.
Fallvorstellung
Die Patientin mit Zahnbehandlungsangst wurde von der Klinik für Oralchirurgie der Universität Basel überwiesen. Sie wünschte den Zahnerhalt sowie die Beseitigung der oralen Entzündungen. Die kaukasische Patientin, Frau T., war zum Zeitpunkt der Befundaufnahme 57 Jahre alt.
Sie lebte von Sozialhilfe und von ihrem Partner getrennt. Frau T. hatte 2 erwachsene Kinder. Bei der Anamnese gab sie an, dass ihre Mutter bereits mit 40 Jahren unter multiplem Zahnverlust litt. Von ihren Geschwistern waren keine parodontalen Probleme bekannt.
Allgemeinmedizinische Anamnese und Tabakkonsum
Die Patientin litt an mehreren Erkrankungen. Es lagen eine alkoholtoxische Leberzirrhose, eine arterielle Hypertonie, eine hyperchlorämische Hyponatriämie, eine Penizillin-Allergie, eine Angststörung, ein langjähriger Nikotinabusus mit Rauchstopp vor 2 Jahren (bis dahin ca. 39 Packungsjahre**), eine Osteoporose sowie ein Vitamin-B12- und ein Vitamin-D-Mangel vor. Die Patientin nahm daher mehrere Medikamente, darunter Beruhigungsmittel (Temesta®) und pflanzliche Stimmungsaufheller (Jarsin®), Vitaminsubstitutionen (Vitamin D3 und B12) und Spurenelemente (Ca), Blutdrucksenker (Candesartan®, Meto Zerok®), Schmerzmittel (Ponstan®) und Gerinnungshemmer (Aspirin Cardio®) ein.
Darüber hinaus wendete sie Hautpflegeprodukte (Excipal®) an. Aus der jüngeren Vergangenheit lag zudem eine intravenöse Bisphosphonat-Therapie (Aclasta®) vor.
Zahnmedizinische Anamnese
Die Patientin gab an, dass bei ihr bereits alio loco verschiedene zahnmedizinische Therapien, darunter eine parodontale Behandlung, durchgeführt wurden. An Details konnte sie sich allerdings nicht erinnern. Es war eine kieferchirurgische Entfernung des Zahnes 38 bekannt.
Nach eigenen Angaben betrieb die Patientin eine regelmäßige Mundhygiene. Sie verwendete eine Mundspüllösung, eine Handzahnbürste sowie Zahnseide und Zahnstocher zur Interdentalraumpflege. Die Mundhygiene wurde morgens, mittags und abends durchgeführt.
Extraorale und intraorale Befunde
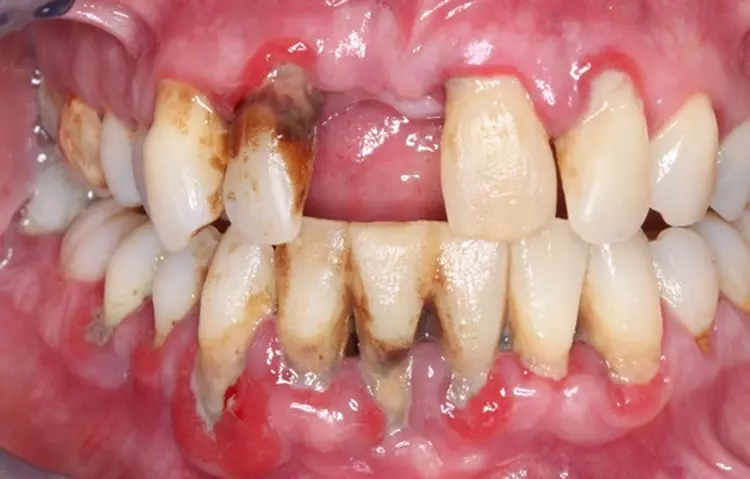
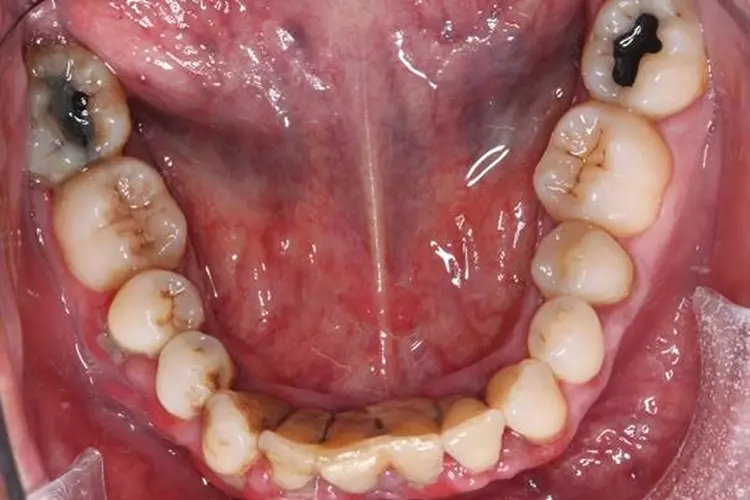
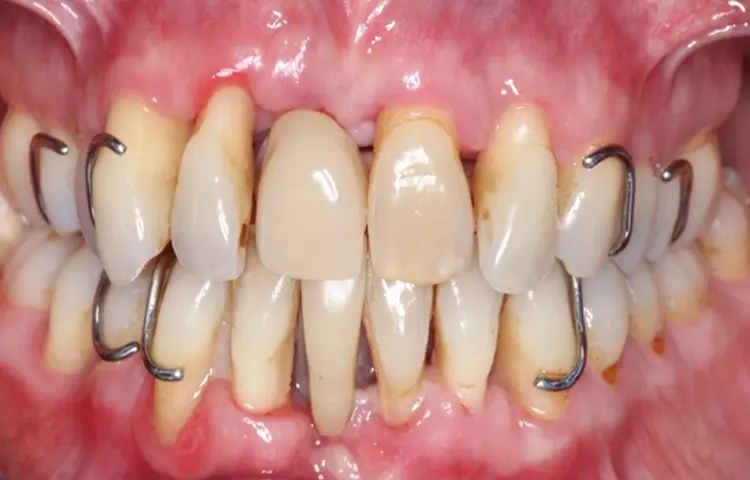
Es fiel ein starker Foetor ex ore auf. Das Gesicht der Patientin erschien gerötet und die Haut unruhig, die oberflächlichen Blutgefäße wirkten erweitert. Die Mundhygiene der Patientin war unzureichend.
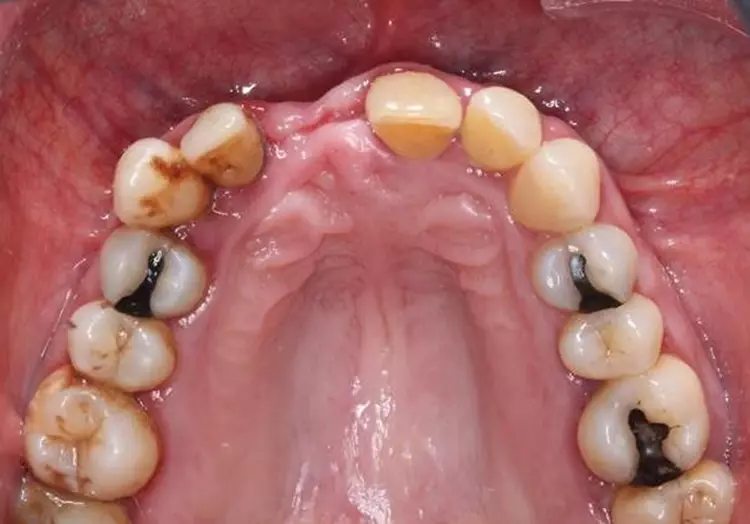
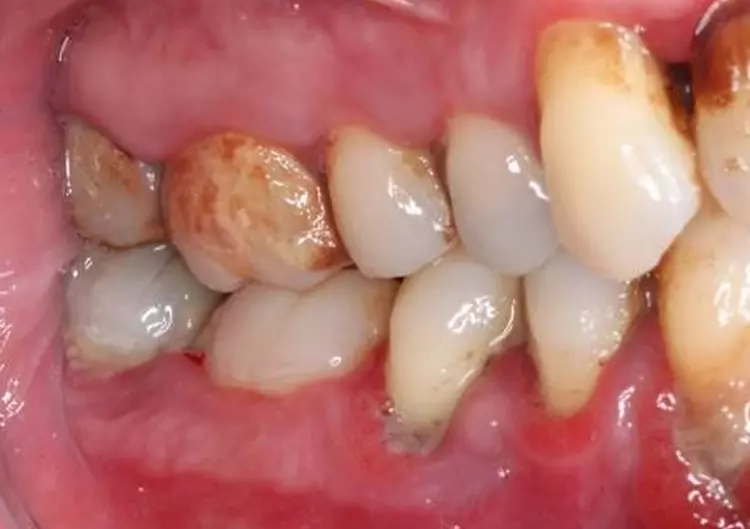
An multiplen Stellen fanden sich mineralisierte und nicht mineralisierte Beläge. Die Gingiva zeigte an zahlreichen Stellen deutliche parodontale Entzündungszeichen im Sinne von lokalisierten rötlichen ödematösen Schwellungen der marginalen Gingiva. Es traten Spontanblutungen auf (Abb. 1 und 2).
Dentaler Befund
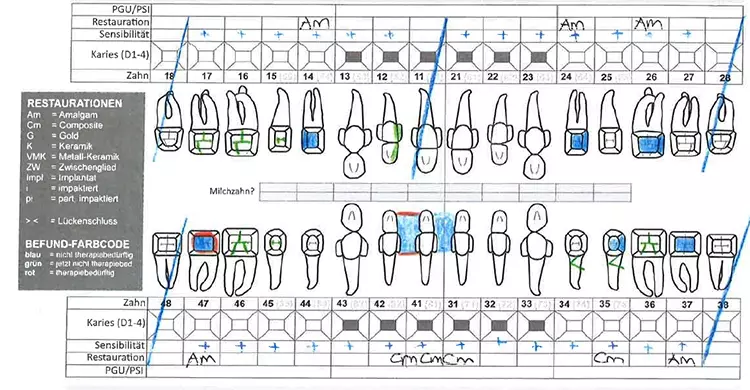
Die Patientin hatte 27 Zähne. Die Zähne 14, 24, 26, 37, 35 und 47 wiesen Amalgam- bzw. Kompositfüllungen auf. Mit Ausnahme von Zahn 47 wurden alle Versorgungen als suffizient eingestuft.
An verschiedenen Zähnen lagen initiale kariöse Läsionen vor, die zu diesem Zeitpunkt weiterer Beobachtung und allenfalls einer Evaluation der Restaurationsnotwendigkeit bedurften. Die Zähne 31, 41 und 42 waren mit Kompositmaterialien geschient. Alle Zähne reagierten auf die mit CO2-Schnee durchgeführten Sensibilitätsproben positiv (Abb. 3).
 Prof. Dr. Clemens Walter
Prof. Dr. Clemens WalterParodontaler Befund
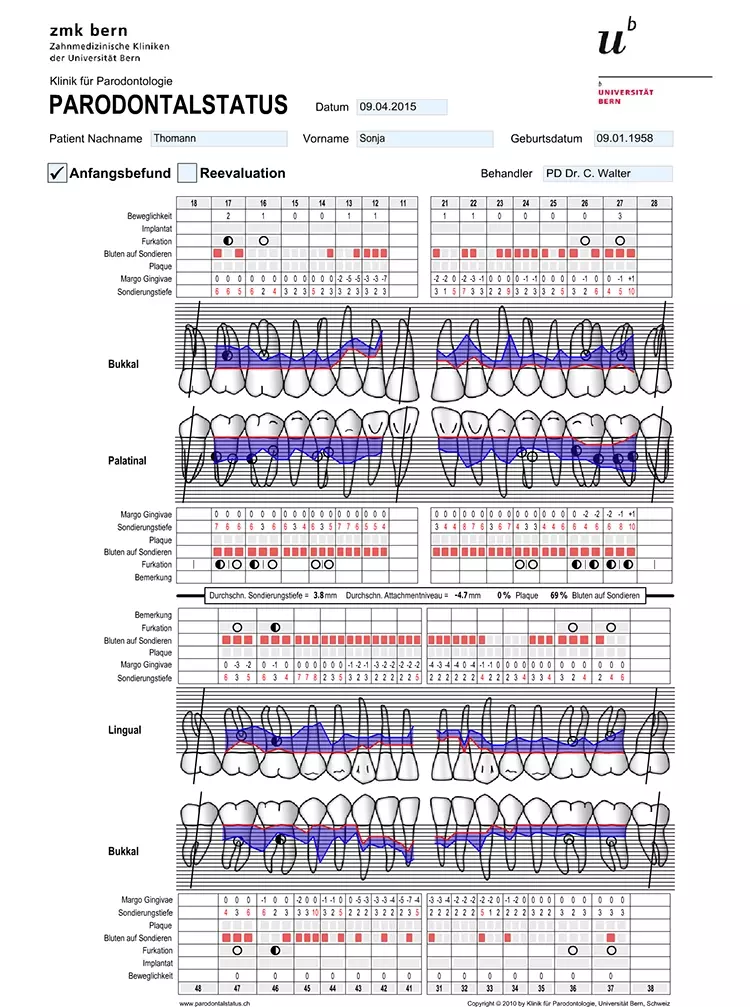
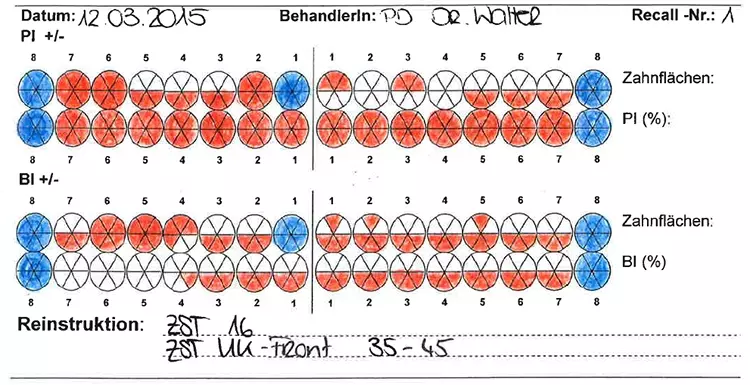
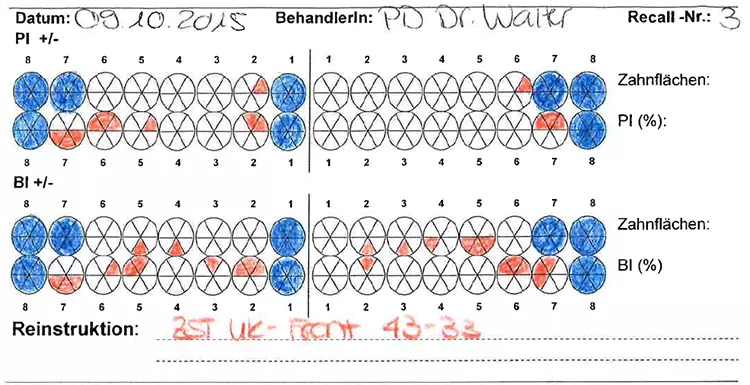
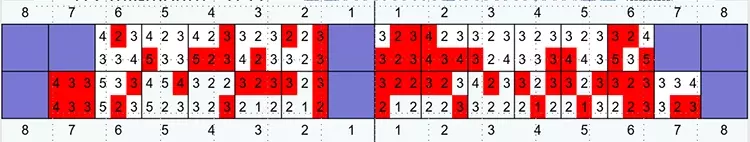
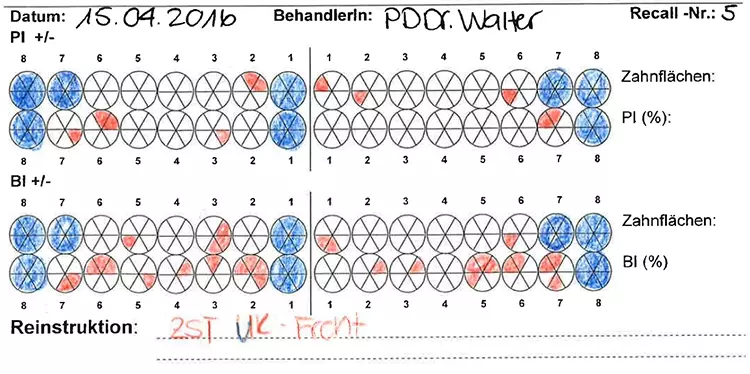
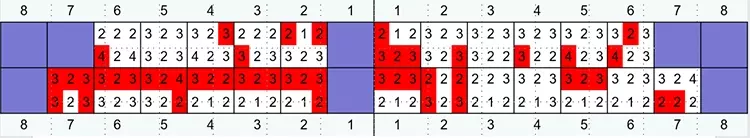
Die Mundhygiene war mit einem Plaque-Index (PI), modifiziert nach O’Leary***, von 77,8% sowie einem Blutungsindex (BI), modifiziert nach Ainamo & Bay****, von 49,4% stark eingeschränkt [2,32]. Die Sondierungstiefen (ST), klinischer Attachmentverlust (AV) sowie das Bluten auf Sondieren (BAS) wurden an 6 Stellen pro Zahn gemessen (Abb. 4). An insgesamt 47 Stellen bestanden Sondierungstiefen von ≥ 6 mm.
 Prof. Dr. Clemens Walter
Prof. Dr. Clemens WalterDie durchschnittliche Sondierungstiefe betrug 3,8 mm und das durchschnittliche Attachmentniveau –4,7 mm. An den Zähnen 17, 16, 26, 27 und 46 bestand bereits fortgeschrittener Furkationsbefall von Grad II bzw. Grad I an den Zähnen 14, 24, 36, 37 und 47 [17]. Das BAS war mit einem Wert von 69% deutlich erhöht [24,25] (Abb. 3).
Ferner wurde die Beweglichkeit bidigital erfasst und nach Miller klassifiziert. An den Zähnen 17, 16, 13, 21, 22 und 27 lagen erhöhte Zahnbeweglichkeiten von Grad 1 oder 2 vor.
Radiologischer Befund
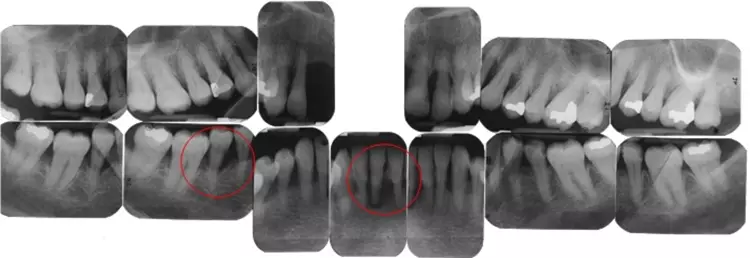
Ein 13-Bilder-Röntgenstatus mit periapikalen Aufnahmen wurde zu Behandlungsbeginn angefertigt. Die interdentalen Knochenstrukturen waren gut zu erkennen und beurteilbar. Es fanden sich zahlreiche Hinweise für parodontale Erkrankungen im Sinne von fortgeschrittenem horizontalem oder vertikalem Attachmentverlust, z.B. an den Zähnen 13, 12, 21, 22, 44 und 45.
Eine zirkumferente apikale Aufhellung im Sinne einer parodontal-endodontalen Läsion war an Zahn 41 ersichtlich. Die radiologische Analyse ergab ferner röntgendichte Verschattungen im Sinne von zahnärztlichen Restaurationen an den Zähnen 14, 24, 26, 37 und 47 (Abb. 5).
 Prof. Dr. Clemens Walter
Prof. Dr. Clemens WalterDiagnosen
Es lag ein konservierend unzureichend versorgtes adultes Gebiss vor. Die vorliegende parodontale Erkrankung wurde entsprechend der neuen Klassifikation für parodontale und periimplantäre Erkrankungen vorgenommen. Diskutiert wurde eine Einstufung in ein Stadium III oder IV [8,34].
Gemein sind beiden Stadien ein interdentaler Attachmentverlust von mehr als 5 mm und ein röntgenologischer Knochenabbau, der bis in das mittlere bzw. apikale Drittel reicht. Zudem lagen folgende Komplexitätsfaktoren für ein Stadium III vor: multiple Sondierungstiefen ≥ 6 mm, fortgeschrittener Furkationsbefall sowie vertikaler Attachmentverlust von ≥ 3 mm. Da > 30% der Zähne betroffen waren, wurde die Ausdehnung als generalisiert beschrieben.
Der Patientin fehlte bereits ein Frontzahn. Die genaue Ursache für den Zahnverlust ließ sich jedoch nicht sicher eruieren. Aufgrund der erhöhten Zahnlockerung (Grad 2 und 3) an den Zähnen 17 und 27 sowie der Elongation des Zahnes 22 lag jedoch eine mastikatorische Dysfunktion vor, die eine interdisziplinäre Therapie erforderte.
Daher wurde eine Einstufung in ein Stadium 4 gewählt. Grad C wurde aufgrund einer indirekten Evidenz für eine schnelle Progressionsrate und einer Modifikation durch den langjährigen Tabakkonsum mit über 20 Schachteljahren als Risikofaktor gewählt. Darüber hinaus bestand der Verdacht auf eine parodontal-endodontale Läsion ohne Beschädigung der Zahnwurzel bei einer Parodontitis von Grad 2 an Zahn 41.
Prognose
Mit Ausnahme der Zähne 17, 27 und 41 wurden alle Zähne, basierend auf dem Ausgangsbefund, als sicher oder – bei fortgeschrittenem Furkationsbefall – als fraglich eingestuft (Tab. 1).
| x | x | |||||||||||||||
| x | x | |||||||||||||||
| x | x | x | x | x | x | x | x | x | ||||||||
| 8 | 7 | 6 | 5 | 4 | 3 | 2 | 1 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| x | x | x | x | x | x | x | x | x | x | x | x | |||||
| x | ||||||||||||||||
| x |
Tabelle 1: Die prätherapeutische Einzelzahnprognose erfolgte entsprechend dem Ampelschema mit den Kriterien „grün“ = sicher, „gelb“ = fraglich und „rot“ = hoffnungslos, bzw. „irrational to treat“. Bei den Zähnen 17, 16, 26, 27 und 37 lag ein Furkationsgrad ≥ 2 vor. Die Zähne 17, 27 wiesen einen Lockerungsgrad (Grad 2 und 3) auf. An Zahn 41 lagen ein Attachmentverlust bis über den Apex und ein erhöhter Lockerungsgrad vor.
Therapieziel und Prognose der gesamten Behandlung
Das primäre Therapieziel war zunächst der Aufbau von Vertrauen und die Beseitigung der parodontalen Entzündung. Zudem sollten ein weiterer Attachmentverlust verhindert und möglichst viele Zähne in ihrer Funktion erhalten werden.
Die Intention war eine weitgehend geschlossene Zahnreihe und möglichst die Vermeidung von größerem prothetischem oder parodontal-chirurgischem Behandlungsbedarf. Unter der Voraussetzung der konsequenten Umsetzung der Therapie wurde der Behandlung gesamthaft eine optimistische gute Prognose gegeben.
Behandlungsablauf
Systemische Phase (Stufe 1)
Zunächst erfolgten eine ausführliche soziale, dental-parodontale und allgemeinmedizinische Anamnese sowie eine orientierende orale Diagnostik mit dem Parodontalen Screening-Index (PSI) (Tab. 2). Es lagen in allen Sextanten Werte bis Grad 4 und zusätzliche Befunde (*), wie erhöhte Lockerung, Furkationsbeteiligung oder Mundschleimhautauffälligkeiten, vor.
| 18-14 | 13-23 | 24-28 |
| 4* | 4* | 4* |
| 4* | 4* | 4* |
| 48-44 | 43-33 | 34-38 |
Tabelle 2: Parodontaler Screening-Index.
Die mitgebrachten Listen mit den aktuellen Medikationen wurden abgeglichen und mit den betreuenden Ärzten Kontakt aufgenommen. Die professionelle supragingivale Zahnreinigung erfolgte an 2 aufeinanderfolgenden Tagen; 3 Wochen später wurde die detaillierte dentale und parodontale Befundaufnahme (Abb. 1 bis 4) durchgeführt.
Die Patientin wurde über ihre individuellen Risikofaktoren und die Behandlungsplanung anhand geeigneter Abbildungen und vor dem Hintergrund ihrer konkreten parodontalen Situation umfassend informiert. Zudem erhielt sie eine Einschätzung über die Prognose und den wahrscheinlichen Verlauf der Therapie.
Es wurde eine stufenweise parodontale Therapie entsprechend des damaligen Behandlungskonzepts der Klinik (systemische, Hygiene- und korrektive Phase sowie unterstützende parodontale Therapie) geplant. Dieser Behandlungsablauf ist gut vergleichbar mit dem in den Leitlinien der Europäischen Gesellschaft für Parodontologie bzw. der Deutschen Gesellschaft für Parodontologie (EFP/DGParo) vorgeschlagenen stufenweisen Therapiekonzept [39].
Zur Reinigung der Interdentalräume wurde die Patientin mit Interdentalraumbürsten (Curaprox CPS prime) instruiert. Die Mundhygiene verbesserte sich innerhalb weniger Wochen. Es wurde ferner angeraten, den vor einigen Jahren erfolgten Rauchstopp beizubehalten.
Vor dem Hintergrund der allgemeinmedizinischen und konkreten zahnbezogenen Befundkonstellation wurde die Entfernung der Zähne 17, 27 und 41 geplant. Zur Extraktion der Zähne wurde die Patientin der Klinik für Oralchirurgie überwiesen. Zudem wurde die insuffiziente Füllung an Zahn 47 ersetzt (Abb. 6 und 7).
Hygienephase mit Reevaluation (Stufe 2)
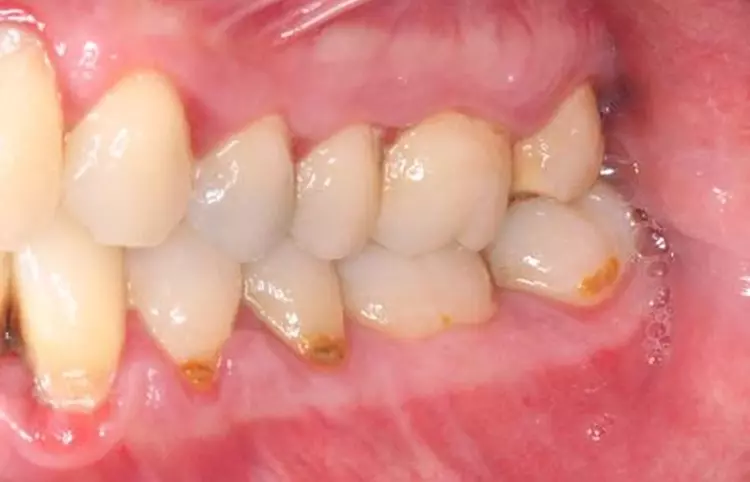
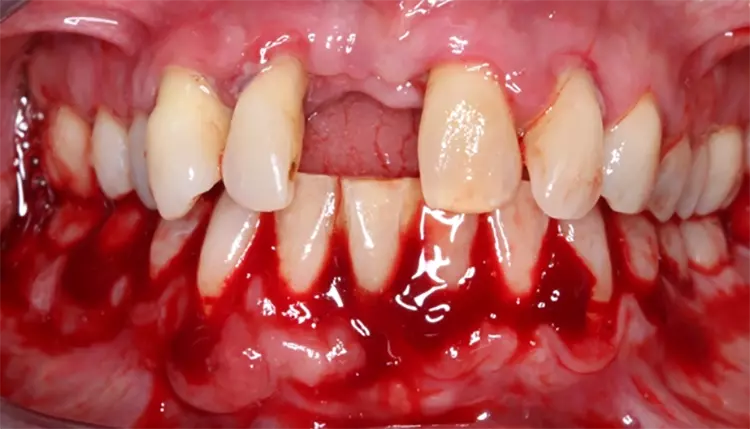
Die systematische subgingivale Instrumentierung erfolgte mit Ultraschall und Handinstrumenten unter Lokalanästhesie in 2 etwa 2-stündigen Behandlungen im Sinne eines Full-Mouth-Scalings an 2 aufeinanderfolgenden Tagen [5,46,47]. Am Tag vor dieser Therapie begann die Patientin mit der adjuvanten systemischen Antibiotika-Einnahme (3 x 1 Azithromycin 500 mg). Nach 1 sowie nach 4 Wochen erschien die Patientin für supragingivale Polituren sowie eine Kontrolle und ggf. erneute Motivierung zur Mundhygiene (Abb. 8 und 9).
Korrektive Phase (Stufe 3)
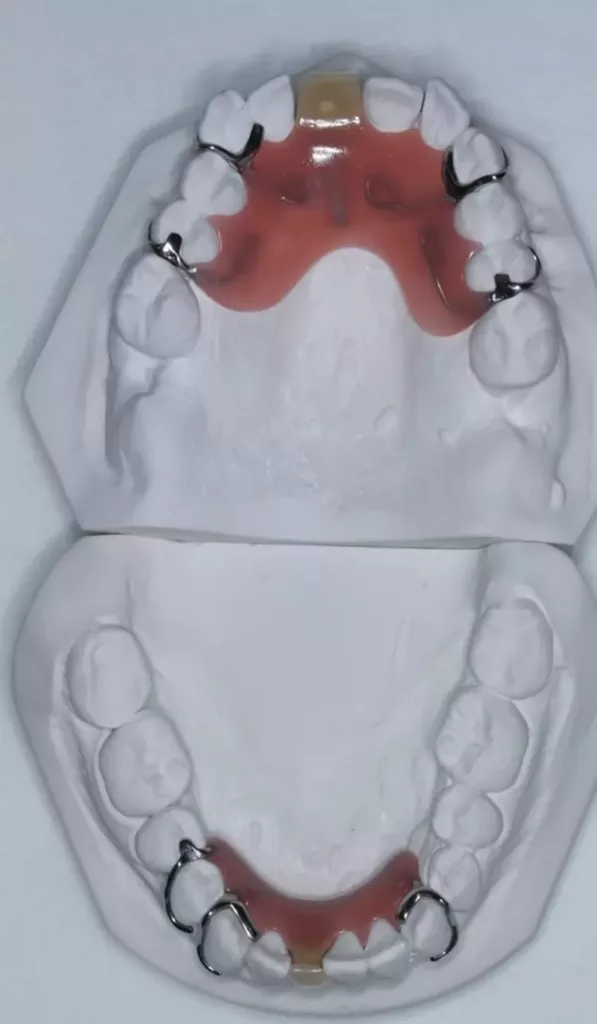
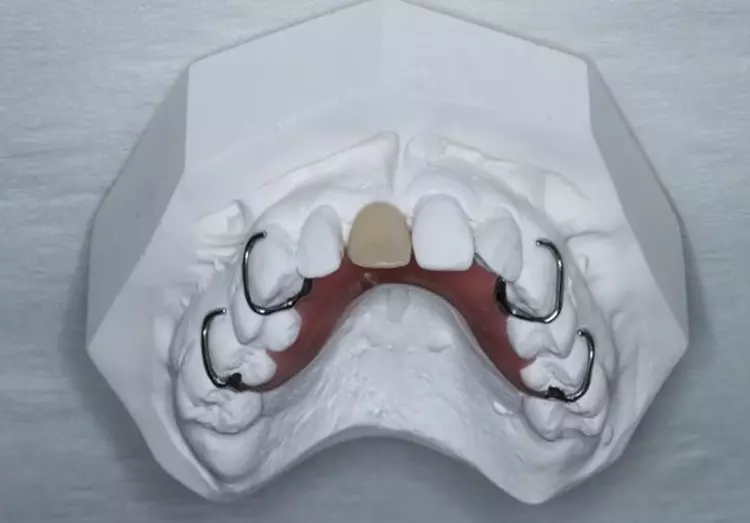
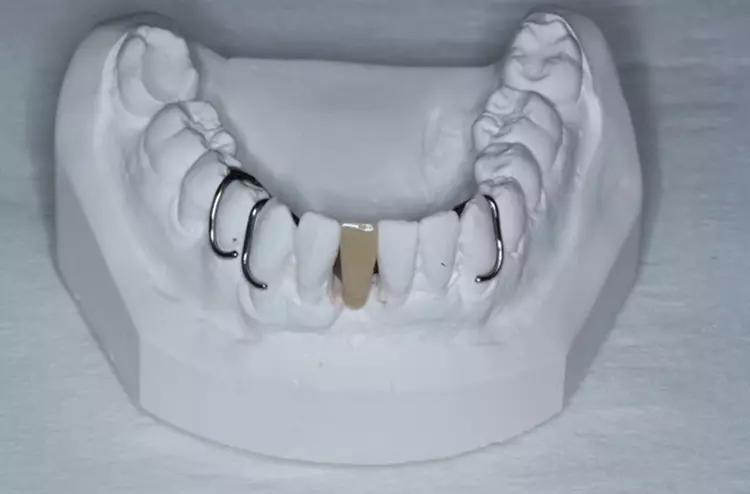
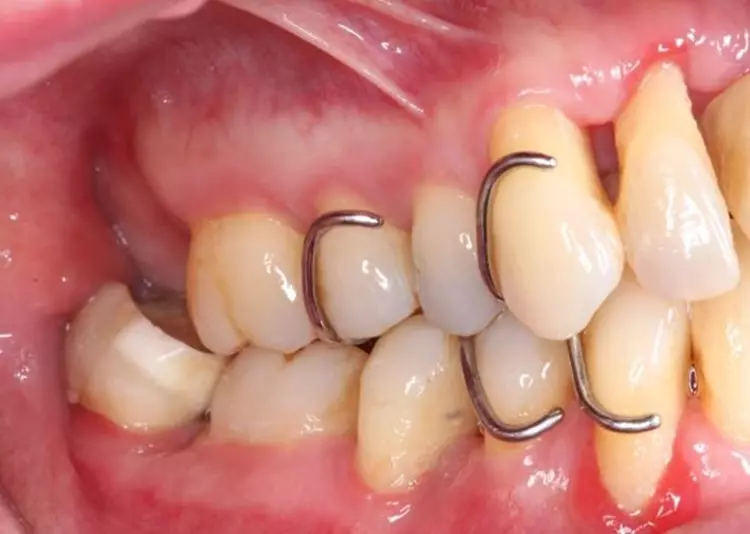
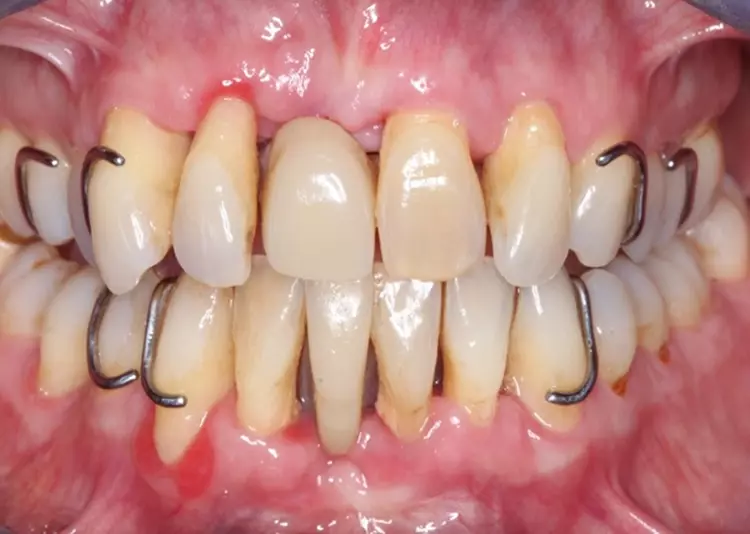
Die Versorgung der Schaltlücken im Ober- und Unterkiefer erfolgte nach der systematischen subgingivalen Instrumentierung. Es wurden 2 kleine Prothesen im Sinne eines Interimsersatzes mit handgebogenen Klammern inseriert (Abb. 10).
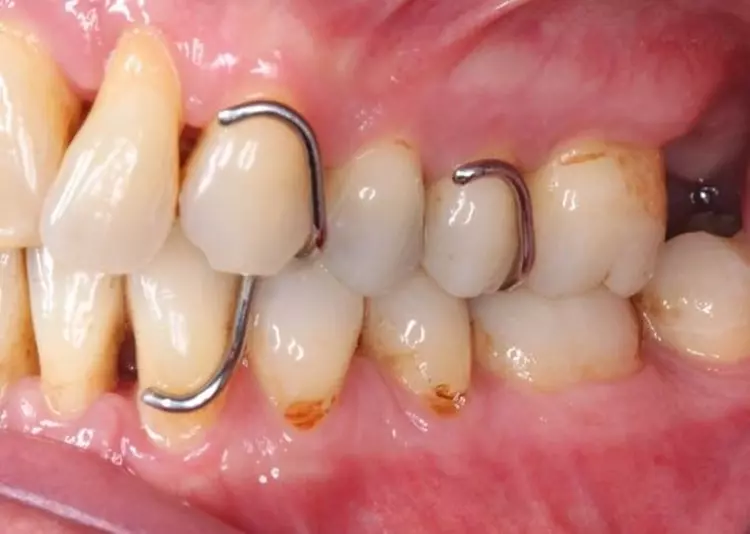
Unterstützende parodontale Therapie (Stufe 4)
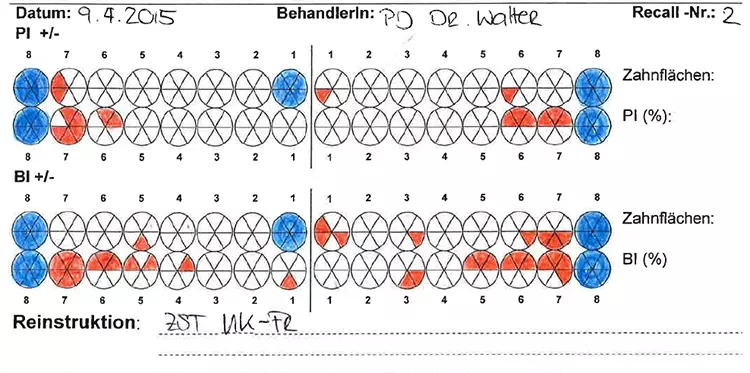
Die Patientin wurde mit einem Intervall von 3 Monaten in die UPT eingebunden. Es erfolgten regelmäßige Erhebungen der parodontalen Parameter sowie eine individuelle Mundhygineinstruktion und -motivierung [4]. Basierend auf den jeweiligen Sondierungstiefen erfolgte jeweils eine bedarfsgerechte supra- und subgingivale Instrumentierung der Wurzeloberflächen, um neu etablierten Biofilm und ggf. Zahnstein/Konkremente zu entfernen [46,47] (Abb. 11 bis 13, Tab. 3).
| initial | + 6 Monate | + 9 Monate | + 12 Monate | |
|---|---|---|---|---|
| Anzahl Zähne | 27 | 24 | 24 | 24 |
| ST>5mm | 47 | 0 | 0 | 0 |
Tabelle 3: Analyse Zahnverlust und Sondierungstiefen. 3 Zähne wurden im Rahmen der sogenannten aktiven Therapie extrahiert. Die verbliebenen Zähne reagierten auf die parodontale Therapie mit einer deutlichen Reduktion der Sondierungstiefe. Kritische Werte > 5 mm lagen nicht mehr vor. Künftig kommt es nun darauf an, das erreichte Resultat weiter zu stabilisieren und die Patientin für die langjährige unterstützende parodontale Therapie (UPT) zu motivieren.
Schlussbetrachtung
Diese Falldokumentation schildert die Behandlung einer multimorbiden Patientin, die zudem zahlreiche Medikamente einnahm. Nach der neuen Klassifizierung handelte es sich um eine generalisierte Grad-C-Parodontitis in Stadium IV.
Die Patientin war langjährige schwere Raucherin und hatte deutliche Defizite in der täglichen häuslichen Mundhygiene. Es wurde eine ausführliche allgemeinmedizinische sowie eine detaillierte Medikamenten-Anamnese durchgeführt. Die interdisziplinäre zahnärztliche Therapie erfolgte in enger Abstimmung mit den betreuenden Ärzten.
Teil 2
Therapeutische Überlegungen
Antibiotika
Im Rahmen einer systematischen Parodontitis-Therapie besteht bei einigen Krankheitsbildern die Empfehlung, die nicht chirurgische Instrumentierung der erkrankten Parodontien mit einer begleitenden systemischen Antibiotikagabe zu ergänzen [15,16,37,46,47]. Dies betrifft vor allem junge Patienten, bei denen eine rasche parodontale Progression nachgewiesen ist (ehemals aggressive Parodontitis). Darüber hinaus – ohne eine klare Leitlinien-basierte Empfehlung – Parodontitis in Zusammenhang mit schweren allgemeinmedizinischen Krankheitsbildern oder auch Parodontitis bei vorangegangener oder aktueller Bisphosphonat-Medikation, sowie ggf. nekrotisierende Parodontalerkrankungen und parodontale Abszesse mit Ausbreitungstendenz [46, 47].
Bei dieser Patientin wurde eine adjuvante systemische Antibiotikagabe verabreicht. Hintergrund war hier die schwere allgemeinmedizinische Symptomatik, insbesondere die positive Bisphosphonat-Anamnese, der langjährige Tabakkonsum, die Angststörung und das dabei angestrebte Ziel einer Vermeidung weitergehender parodontal-chirurgischer Eingriffe. Wird die übliche Kombination der systemischen oralen Antibiotika Amoxicillin und Metronidazol eingesetzt, sollte im Rahmen der Therapieplanung berücksichtigt werden, dass es gegen beide Medikamente allergische Reaktionen geben kann und Metronidazol zudem eine antabusartige Wirkung aufweist.
Wünschenswert ist in solchen Fällen zudem das Vorliegen eines Allergiepasses oder eine entsprechende weiterführende Abklärung beim Hausarzt respektive Allergologen. Selbstverständlich sind ggf. weitere unerwünschte Nebenwirkungen und Kontraindikationen wie Schwangerschaft oder gerinnungshemmende Medikamente zu berücksichtigen. Nach Rücksprache mit dem behandelnden Arzt der Patientin wurde aufgrund des Alkoholabhängigkeits-Syndroms und der Penizillin-Allergie die Gabe von Metronidazol in Kombination mit Amoxicillin abgelehnt.
Eine systemische Antibiose aus Azithromycin dagegen stellt oft eine gute Alternative dar. Die Patientin erhielt Azithromycin (500 mg 1-mal täglich für 3 Tage, beginnend am Tag vor der subgingivalen Instrumentierung) als adjuvante Antibiose. Eine aktuelle Übersichtsarbeit zeigt einen klinischen Vorteil von systemisch verabreichtem Azithromycin in der nicht chirurgischen Therapie chronischer Parodontitiden und Raucherparodontitiden gegenüber der Therapie ohne Antibiose [7]. Auch erste klinische Daten zum Vergleich gegenüber Amoxicillin und Metronidazol im Rahmen der Therapie chronischer Parodontitiden sind vielversprechend [19].
Bisphosphonat-Therapie
Bisphosphonate zeigen eine hohe Affinität für Kalzium sowie die Eigenschaft, Osteoklasten zu inhibieren und damit Einfluss auf den Knochenstoffwechsel zu nehmen. Der Einsatz von Bisphosphonaten erfolgt im Rahmen einer Reihe unterschiedlicher Indikationen wie beispielsweise einer tumorinduzierten Erhöhung des Kalziumspiegels, bei Knochenmetastasen, Neoplasien und weiteren Krankheitsbildern.
Ein anderer Aspekt betrifft – wie bei der hier vorgestellten Patientin – die Medikation bei postmenopausalen Frauen mit Osteoporose [11,20]. Diese erhalten mitunter eine pharmakologische Therapie mit Bisphosphonaten, die den physiologischen Knochen-stoffwechsel beeinflussen. Neben anderen therapeutischen Nebenwirkungen kann sich unter einer Bisphosphonat-Therapie eine Osteonekrose des Kieferknochens entwickeln. Diese ist insofern tückisch, da die Anfangsphase dieser Art der Osteonekrose oft symptomlos verläuft. Als erstes Symptom zeigt sich das klinische Bild des freiliegenden Kieferknochens, und später kommt es im Zusammenhang mit einer bakteriellen Infektion des freiliegenden Kieferbereichs zur Schwellung, Exsudation, Foetor ex ore, Zahnlockerung, Sensibilitätsstörung sowie schließlich zu Schmerzen [35].
Da eine Bisphosphonat-assoziierte Osteonekrose der Kiefer eine schwere Komplikation darstellt, die im Zusammenhang mit parodontalen Eingriffen auftreten kann [6], ist bei entsprechenden Patienten eine genaue Medikamenten-Anamnese indiziert. Im ärztlichen Gespräch sollten das Präparat, der Zeitraum und die Art der Applikation (oral oder intravenös) erfragt werden. Die Indikation für jegliche chirurgische Intervention sollte präzise gestellt und in diesem Zusammenhang eine prophylaktische antibiotische Begleittherapie geplant werden. Diese Antibiotikaprophylaxe sollte in Abhängigkeit von der Darreichungsform nach den aktuellen Empfehlungen der entsprechenden Fachgesellschaften erfolgen. Aktuelle Leitlinien, Empfehlungen zur antibiotischen Prophylaxe und Therapie der Bisphosphonat-assoziierten Osteonekrose sind auf den Internetseiten der Fachgesellschaften***** sowie in PubMed dargestellt [20,21,22,38]. Bei der hier vorgestellten Patientin erfolgte die Extraktion der Zähne 17, 27 und 41 in der Klinik für Oralchirurgie. Neben einer perioperativen Abschirmung mit Clindamycin erfolgten zusätzlich primäre plastische Deckungen der Extraktionsalveolen.
Gerinnungshemmende Medikation
Die Nichtberücksichtigung einer gerinnungshemmenden Medikation kann schwere Komplikationen verursachen [45]. Neben der hier vorliegenden Aspirinmedikation lag bei der Patientin eine fortgeschrittene Leberzirrhose vor, die zusätzlich einen relevanten Einfluss auf die Gerinnungsneigung des Blutes haben kann. Andere Patienten nehmen mitunter andere Präparate aus dem weiten Feld der Antikoagulanzien regelmäßig ein, die einen anderen Wirkmechanismus aufweisen. In jedem Fall sollten die genauen Präparate in der Anamnese erfragt, die Therapie in enger Zusammenarbeit mit dem behandelnden Hausarzt respektive Internisten und ggf. einem Monitoring der Blutgerinnung durchgeführt werden [42].
Zur besseren Vergleichbarkeit von Testergebnissen zur Blutgerinnung empfiehlt die Weltgesundheitsorganisation (WHO) die Angabe der In-vitro-Gerinnbarkeit, d.h. der Gerinnungsdauer, als INR (International Normalized Ratio)******. Die bisher gebräuchliche Angabe des prozentualen Anteils des normalen Gerinnungswerts als Quickwert hat durch die interindividuellen Unterschiede zu Unsicherheiten in der Dosierung und Beurteilung der oralen Antikoagulation geführt. Der physiologische Bereich des INR liegt zwischen 0,9 und 1,2, der therapeutische Bereich je nach Indikation zwischen 2,0 und 3,5. Die Gerinnungshemmung oder anders ausgedrückt die Blutungsneigung steigt mit zunehmendem INR. Die hier vorgestellte Patientin wies aufgrund ihrer kardiovaskulären Erkrankungen eine tägliche Medikation mit Aspirin Cardio® (100 mg) auf. Nach Rücksprache mit der Hausärztin wurde auf ein Absetzen der Medikation verzichtet. Die Hausärztin war über die Art der geplanten Therapie sowie über die entsprechenden Termine informiert.
Es erfolgte eine individuelle Abschätzung der Blutungsneigung. In einem unkritischen parodontalen Areal mit nur gering erhöhten Sondierungstiefen wurde zunächst eine Art Probe-Instrumentierung vorgenommen. Erst danach sollte das weitere Prozedere definiert werden. Es wurde entschieden, die subgingivale Instrumentierung in 2 Therapiesitzungen an 2 aufeinander folgenden Tagen durchzuführen. Zur Blutstillung wurde mit Wasserstoffperoxid (3%) gut gespült. Nach der Therapie wartete die Patientin jeweils im Wartezimmer, nach einer Stunde wurde die Blutstillung nochmals kontrolliert und die Patientin entlassen.
Vitamin D
Die Patientin wies eine Osteoporose auf und litt unter einem Vitamin-D-Mangel. Vitamin D spielt in zahlreichen physiologischen Prozessen eine wichtige Rolle. Obwohl ein Vitamin-D-Mangel mit einem erhöhten Risiko für zahlreiche Erkrankungen assoziiert ist, besteht nach wie vor Unklarheit über den Einfluss des Vitamin-D-Status auf parodontale Erkrankungen. Während epidemiologische Studien eine Assoziation mit Parodontitis respektive Gingivitis nahelegen, fehlen valide Daten aus randomisierten longitudinalen Studien hinsichtlich des Effektes einer Substitution mit Vitamin D auf den Verlauf parodontaler Erkrankungen. Bezüglich praxisreifer Empfehlungen ist daher hinsichtlich einer Vitamin-D-Substitution aus parodontalen Gründen noch Zurückhaltung geboten [13].
Kardiovaskuläre Erkrankungen
Die Gewebe des Zahnhalteapparates sind außergewöhnlich gut durchblutet, sodass Bakteriämien und eventuell schädigende Wirkungen auf das kardiovaskuläre Organsystem möglich sind. Bei einer generalisierten Parodontitis in einem Gebiss mit etwa 28 Zähnen beträgt die mit Mikroorganismen besiedelte Wundfläche ungefähr 100 cm2. Das entspricht annähernd der Größe einer Handinnenfläche [50]. Ein derartig großes, krankhaft verändertes Areal wirkt sich auch auf das Immunsystem aus. So kann eine unbehandelte Parodontitis das Risiko für Erkrankungen des Herz-Kreislauf-Systems, wie z.B. Arteriosklerose oder Herzinfarkte, erhöhen. In diesem Fall lag bei der Patientin ein Hypertonus vor.
Aktuelle Untersuchungen zeigen auch hier eine Assoziation mit parodontalen Erkrankungen. So zeigten Muñoz und Mitarbeiter (2020) im Rahmen einer systematischen Übersichtsarbeit mit einer Metaanalyse anhand 40 eingeschlossener Studien, dass moderate und schwere parodontale Erkrankungen mit einem Hypertonus assoziiert sind [29]. Dies wurde auch durch einige prospektive und erste interventionelle Studien untermauert. Bei der hier vorgestellten Patientin war zu berücksichtigen, dass die vorgeschlagene Medikation im Rahmen der geplanten systemischen unterstützenden Antibiose mit Azithromycin kardiale Nebenwirkungen im Sinne eines verlängerten QT-Intervalls aufweisen kann.
Eine Übersichtsarbeit von Abdulhak und Mitarbeitern (2015) ging der Frage einer erhöhten kardiovaskulären Letalität nach Azithromycin-Antibiose nach [1]. Die Analyse von 5 eingeschlossenen Studien zeigte bei jüngeren im Gegensatz zu älteren Patienten kein erhöhtes Risiko für einen Todesfall kardiovaskulärer Genese. Demnach besteht insbesondere bei letztgenannter Gruppe die Notwendigkeit einer kritischen Analyse des Allgemeinzustands und ggf. zur Berücksichtigung einer alternativen antimikrobiellen Therapie. Nach Rücksprache mit der betreuenden Hausärztin konnte der Patientin Azithromycin im Rahmen der parodontalen Therapie verschrieben werden.
Alkoholismus und Angststörung
Die Patientin litt unter einer Alkoholabhängigkeit und einer Angststörung, die in der Vergangenheit bereits stationär in einer Fachklinik therapiert wurde. Einige neuere Studien zeigen eine relevante Assoziation zwischen dem Alkoholkonsum und parodontalen Erkrankungen. So analysierten Wang und Mitarbeiter (2016) in einer Meta-Analyse von 18 Studien diesen Zusammenhang [49]. Sie zeigten, dass eine signifikante Dosis-Wirkungs-Beziehung besteht und das Risiko für eine Parodontitis mit steigendem Konsum zunimmt. Gesteigerter Alkoholkonsum kann zu Erkrankungen, darunter Angsterkrankungen und depressiven Verstimmungen, Schlafstörungen, Bluthochdruck, Krebs, Vitaminmangel oder Erkrankungen des metabolischen Systems führen. Daher sind die Patienten meist multimorbid erkrankt und auf Polymedikation angewiesen. Der Alkoholismus und die damit einhergehenden Entzugserscheinungen bei Dosisreduktion sowie die entsprechenden psychosomatischen Symptome können so relevanten Einfluss auf die Compliance der Patienten und die zahnärztliche Therapie parodontaler Erkrankungen nehmen. Im Rahmen der parodontalen Therapie kann es ferner indiziert sein, die mechanische Zerstörung des subgingivalen Biofilms mit einer systemischen Antibiotikatherapie mit der Kombination aus Amoxicillin und Metronidazol zu ergänzen [37,43,46,47]. Aufgrund der bereits diskutierten Antabuswirkung entsteht bei Alkoholikern jedoch eine Unverträglichkeit auf Metronidazol.
Tabakkonsum
Das Thema Tabakkonsum wird von vielen Zahnärzten gerne gemieden. Dennoch besteht ein erhöhtes, tabak-assoziiertes Risiko für pulmonale oder kardiovaskuläre Komplikationen oder verschiedene Karzinome – darunter auch orale Plattenepithelkarzinome. Und es liegt mittlerweile hochstehende wissenschaftliche Evidenz vor für den deutlichen Einfluss des Tabakkonsums auf parodontale und periimplantäre Erkrankungen. Schon Publikationen aus der Mitte des 20. Jahrhunderts beschrieben den Tabakkonsum als Risikofaktor für bestimmte parodontale Erkrankungen [36,45,49].
Die jüngere zahnmedizinische Forschung konnte in den vergangenen Jahren zahlreiche neue pathogenetisch und therapeutisch wichtige Erkenntnisse generieren. Der Tabakkonsum wird demzufolge heute neben der supragingivalen Plaquekontrolle als der bedeutendste modifizierbare Risikofaktor auch für diese oralen Erkrankungen angesehen. Es gilt als erwiesen, dass Bindegewebe, Knochen und Blutversorgung des gesamten Parodonts sowie das Immunsystem in ihren physiologischen Funktionen beeinträchtigt werden [33,40,48]. Es handelt sich offenbar bei der Tabakkonsum-assoziierten parodontalen Destruktion nicht um einen eindeutigen eindimensionalen, beispielsweise antiinflammatorischen Effekt, sondern vielmehr um eine vielschichtige Beeinflussung unterschiedlicher Zell- und Gewebefunktionen [44].
Darüber hinaus ist eine veränderte mikrobielle Zusammensetzung wahrscheinlich, die jedoch aufgrund der enormen Komplexität der oralen Flora nicht mit Sicherheit nachgewiesen werden konnte. Einige Studien zeigen zudem einen Zusammenhang von Tabakkonsum und genetischen Faktoren [27]. Es besteht eine Zeit-Dosis-Beziehung bezüglich der Auswirkungen des Tabakkonsums auf das Parodont [12]. So zeigen sich mit steigendem Tabakkonsum höhere parodontale Sondierungswerte, mehr klinischer Attachment- und Alveolarknochenverlust, eine verstärkte Neigung zur Entstehung gingivaler Rezessionen sowie ein höheres Risiko für Zahnverlust. Einigen Studien zufolge sind diese Symptome in den anterioren Kieferbereichen besonders ausgeprägt [18]. Demgegenüber sind die klassischen klinischen Entzündungszeichen einer Gingivitis oder das Bluten auf parodontales Sondieren bei Rauchern reduziert und somit weniger auffällig [12].
Raucher zeigen darüber hinaus schlechtere Ergebnisse nach konventioneller, chirurgischer, chirurgisch-regenerativer und chirurgisch-plastischer Parodontaltherapie [14,41]. Bei der hier behandelten Patientin lag sowohl im Oberkiefer als auch im Unterkiefer je eine Schaltlücke vor. Prinzipiell wäre hier eine implantologische Versorgung zu diskutieren. Vor dem Hintergrund multipler Risikofaktoren, darunter einer parodontalen Vorgeschichte und einer Bisphosphonattherapie, wurde von einer implantologischen Versorgung abgesehen. Im Rahmen der dentalen Implantologie sollte berücksichtigt werden, dass der langjährige Tabakkonsum die Osseointegration von oralen Implantaten beeinträchtigt und für einen Großteil der biologischen Komplikationen, wie der Periimplantitis, verantwortlich ist. In einer aktuellen Bestandsaufnahme zum Tabakkonsum und oralen Implantaten konnten 6 aktuelle wissenschaftlich hochstehende systematische Übersichtsarbeiten identifiziert werden.
Die Wahrscheinlichkeit eines Implantatmisserfolges ist demnach um das Zwei- bis Dreifache bei Rauchern gegenüber Nichtrauchern erhöht [3,9,10,28,30,31,48]. Das Parodont kann sich nach einem Rauchstopp erholen. Der Grad der Regeneration ist abhängig von der Menge und der Dauer täglich konsumierter Zigaretten vor der Entwöhnung und der Zeit nach dem Rauchstopp.
Zusammenfassung
Die allgemeinmedizinischen Erkrankungen und umfassenden Medikationen beeinflussten die zahnärztliche Therapie dieser Patientin an mehreren Punkten (Tab. 4 und 5). Durch die enge Zusammenarbeit mit Kolleginnen und Kollegen unterschiedlicher Fachrichtungen und die erfolgten therapeutischen Maßnahmen konnte die parodontale Gesundheit der Patientin aber weitestgehend verbessert und die Stabilität der Zähne wiederhergestellt werden.
| Erkrankung | Potenzielle Auswirkungen auf die parodontale Therapie | Einfluss auf parodontale Erkrankungen + Therapie |
| Alkoholismus | Assoziation mit parodontalen Erkrankungen, Compliance, Kontraindikation für Metronidazol | + |
| Leberzirrhose | Blutgerinnung | + |
| Vitamin-B12-Mangel | Anämie, neurologische und psychiatrische Symptome | + |
| Angststörung | Compliance | + |
| Penizillin-Allergie | adjuvante systemische Antibiotikatherapie | + |
| Hypertonie | Assoziation mit parodontalen Erkrankungen | + |
| Osteoporose | Knochendichte, Knochenstoffwechsel | + |
| Vitamin-D-Mangel | Knochendichte, Knochenstoffwechsel | + |
| Tabbakkonsum | multiple pathogenetische Effekte, eingeschränkte Therapieergebnisse | + |
Tabelle 4: Erkrankungen der Patientin und potenzieller Einfluss auf die Pathogenese und/oder die Therapie parodontaler Erkrankungen.
| Präparat | Wirkung/Anwendung | Einfluss auf parodontale Erkrankungen und Therapie |
| Vitarubin® | Vitamin-B12-Substitution | |
| Candesartan® | RR ▼, Angiotensin-II-Rezeptor-Antagonist mit Diuretikum | ? |
| Meto Zerok® | RR ▼, Betablocker | ? |
| Aspirin Cardio® | Gerinnungshemmer | + |
| Calcium® | Spurenelement | + |
| Jarsin® | pflanzlicher Stimmungsaufheller | |
| ViDe3 | Vitamin-D-Substitution | +/- |
| Aclasta®, i.v. | Bisphosphonat | + |
| Temesta® (in D Tavor) | Psychopharmakon, Beruhigungsmittel | ? |
| Ponstan® (Mefaminsäure) | Schmerzmittel | + |
| Excipial® | Hautpflege, trockene Haut |
Tabelle 5: Medikamentenliste der Patientin und potenzieller Einfluss auf die Pathogenese und die Therapie parodontaler Erkrankungen.
Der bisherige Verlauf, der über ein Jahr in der UPT belegt wurde, zeigt überwiegend parodontal stabile Verhältnisse und eine klinisch relevante Abnahme der Sondierungswerte ab 5 mm. Die Patientin konnte zu einer sehr guten Mundhygiene motiviert werden und hält die zahnärztlichen Termine ein. Die UPT wird nun mit einem Intervall von 3 Monaten konsequent weitergeführt, um das Behandlungsergebnis zu sichern und weiter zu stabilisieren.
 Entdecke CME Artikel
Entdecke CME Artikel  Entdecke Artikel mit Download
Entdecke Artikel mit Download 



 Mit Google einloggen
Mit Google einloggen
 Mit Facebook einloggen
Mit Facebook einloggen
Keine Kommentare.