Bitte loggen Sie sich ein um weiterzulesen
Neu hier?
Jetzt kostenlos unbegrenzten Zugang zu exklusiven Inhalten und Funktionen erhalten.
Kostenlos registrierenoder
Bereits seit 1939 finden sich in der Literatur Beschreibungen zu Fällen von MIGH [1]. Dieses Krankheitsbild hat in den vergangenen Jahrzehnten aufgrund einer steigenden Anzahl von identifizierten Medikamenten, die zu einer gingivalen Wucherung führen können [2,3], an Bedeutung gewonnen. Die aktuelle Klassifikation von parodontalen und periimplantären Erkrankungen und Zuständen aus dem Jahr 2018 führt die MIGH als Unterkategorie der plaqueinduzierten Gingivitis [2].
Ätiologie: Medikamente, weitere Einflüsse
Auslöser für die gingivalen Veränderungen sind v.a. 4 verschiedene Medikamentengruppen: (1) Kalziumkanalblocker, wie Nifedipin, Amlodipin, Verapamil, Diltiazem und Felodipin, (2) Antiepileptika (z.B. Phenytoin), (3) Immunsuppressiva (z.B. Cyclosporin A) und (4) hoch dosierte orale Kontrazeptiva [2]. Die Prävalenz der MIGH unterscheidet sich erheblich nach Wirkstoff und Konzentration des ursächlichen Medikamentes. Bei Kalziumkanalblockern, die in der Summe in Deutschland am häufigsten als Antihypertensiva verschrieben werden, liegt die Prävalenz aktuellen Zahlen zufolge für Amlodipin bei 20 bis 30% und für Nifedipin bei über 70% [4].
Im Falle von Antiepileptika, konkret Phenytoin, wird die Prävalenz mit bis zu 70% beschrieben [5]. Obwohl sich die Wirkstoffe der verschiedenen Arzneimittel deutlich unterscheiden, ähneln sich die sich daraus ergebenden dentalen klinischen Befunde [6]. So präsentieren sich MIGH in der Regel 1 bis 3 Monate nach der ersten Medikamenteneinnahme, wobei die initialen Wucherungen vorwiegend interdental auftreten, an den labialen Flächen der Oberkieferfrontzähne, und auf die befestigte Gingiva begrenzt sind.
Das Zahnfleisch zeigt sich dabei verdickt und gelappt, kann aber auch eine knötchenartige Oberfläche aufweisen [7]. Obwohl es eine Tendenz zur Ausbreitung in den Seitenzahnbereich gibt, also zu einer generalisierten Form, ist dieser Bereich der Prämolaren und Molaren eher seltener betroffen [7].
Das gemeinsame histologische Bild zeigt zumeist eine exzessive Vermehrung spindelförmiger Fibroblasten und eine Steigerung der Kollagensynthese im Bereich der Gingiva [6], jedoch gibt es pathogenetisch durchaus Unterschiede bei den verschiedenen Formen. Bis heute ist der genaue Mechanismus noch immer nicht bekannt, sicher ist nur, dass sowohl nicht entzündliche als auch entzündliche Prozesse beteiligt sind [8]. Ebenso wird diskutiert, dass genetische Einflüsse zu einer erhöhten Prädisposition und Variabilität der MIGH führen können [9].
Variables klinisches Erscheinungsbild
Für Patientinnen und Patienten stellt die MIGH nicht nur eine funktionelle, sondern auch eine ästhetische Einschränkung dar [5]. Die Wucherungen führen zudem häufig dazu, dass nur noch eine eingeschränkte häusliche Mundhygiene möglich ist. Es beginnt eine Art Teufelskreis, der eine erhöhte Plaqueakkumulation bedingt, welche wiederum die Entstehung einer Gingivitis bzw. bei chronischem Verlauf auch einer Parodontitis fördern kann [2,10].
Zusätzliche Reizfaktoren, wie beispielsweise insuffiziente Restaurationsränder, oder nicht veränderbare Faktoren, wie das Patientenalter, begünstigen zudem die Entwicklung einer Hyperplasie der Gingiva und in der Folge ggf. auch einer Parodontitis [2,8,10]. Bei all diesen Einflüssen verwundert die große Variabilität im Erscheinungsbild nicht [2]. Auch sollte beachtet werden, dass die resultierenden psychosozialen Folgen für die Betroffenen bisher kaum näher untersucht wurden [11,12].
Unbekannte Prävalenz
In Deutschland leidet laut Robert-Koch-Institut jeder Dritte an Bluthochdruck [13,14] und obwohl nicht jede Hypertonie medikamentös behandelt wird, haben auch die damit einhergehenden pharmazeutischen Behandlungen in absoluten Zahlen zugenommen [15,16]. Bei den 65-Jährigen sind sogar 2 von 3 Personen betroffen. Dabei werden die Patientinnen und Patienten immer häufiger nicht mit einem einzigen Medikament, sondern mit Medikamentenkombinationen behandelt.
So stieg der Anteil an Patientinnen und Patienten, die mit mehreren Medikamenten behandelt wurden, von 56,2% (1998) auf 67,1% (2008) an [13,17]. Kalziumkanalblocker machen mit 25% einen Hauptteil der verschriebenen Antihypertensiva aus [17]. Laut dem BARMERArzneimittelreport von 2022 belegte Amlodipin im Jahr 2021 Platz 8 der meistverschriebenen Medikamente unter den Versicherten [18].
Aktuelle Studien zeigen auf, dass die Prävalenz von Amlodipin-assoziierten gingivalen Hyperplasien inzwischen bei 20 bis 38% liegen dürfte [4,19,20], wobei das Risiko für das Auftreten einer MIGH mit der Dauer und Dosis der Einnahme steigt [21,22]. Wichtig zu erwähnen ist allerdings, dass nur wenige der Patientinnen und Patienten letztendlich eine MIGH entwickeln.
So sind in der zahnärztlichen Praxis mit Sicherheit viele Patientinnen und Patienten mit einer entsprechenden Medikamentenanamnese zu finden. Für das Praxisteam ist es entscheidend, potenzielle Risikopatientinnen und -patienten zu identifizieren, um zum einen die MIGH bei Auftreten professionell behandeln zu können, aber auch um allgemeinmedizinische Komplikationen, die bei Patientinnen und Patienten mit kardialen Vorerkrankungen vorliegen können, sicher zu managen.
Patientenfall: MIGH und Parodontitis
Im Mai 2022 stellte sich eine 39-jährige Patientin erstmalig im Funktionsbereich Parodontologie der Klinik für Zahnerhaltung und Parodontologie des Universitätsklinikums Schleswig-Holsteins (UKSH) mit ihrem Empfinden nach stark geschwollenem und teilweise spontan blutendem Zahnfleisch vor. Bei der Erhebung der Anamnese gab die Patientin an, an einem Hypertonus zu leiden, der vor ca. 6 Monaten mit dem Kalziumantagonisten Amlodipin medikamentös eingestellt wurde.
Zusätzlich beschrieb die Patientin, gelegentlich einen Verdampfer mit Nikotin zu nutzen. Zur speziellen zahnmedizinischen Anamnese konnte ermittelt werden, dass der letzte Zahnarztbesuch etwa ein Jahr zurücklag und zu diesem Zeitpunkt noch keine Auffälligkeiten im Bereich des Zahnfleisches vorlagen. Die Patientin nutzte laut eigenen Angaben keine Interdentalraumbürsten, sondern lediglich eine weiche Handzahnbürste zur täglichen häuslichen Mundhygiene.
Im Rahmen der klinischen Befunderhebung wurde neben dem dentalen Befund auch ein parodontaler Status mit Taschensondierungstiefen, Bluten auf Sondierung, Rezessionen, Furkationen, Mobilität und Plaque erstellt. Der Ausgangsbefund ist in Abbildung 1 dargestellt.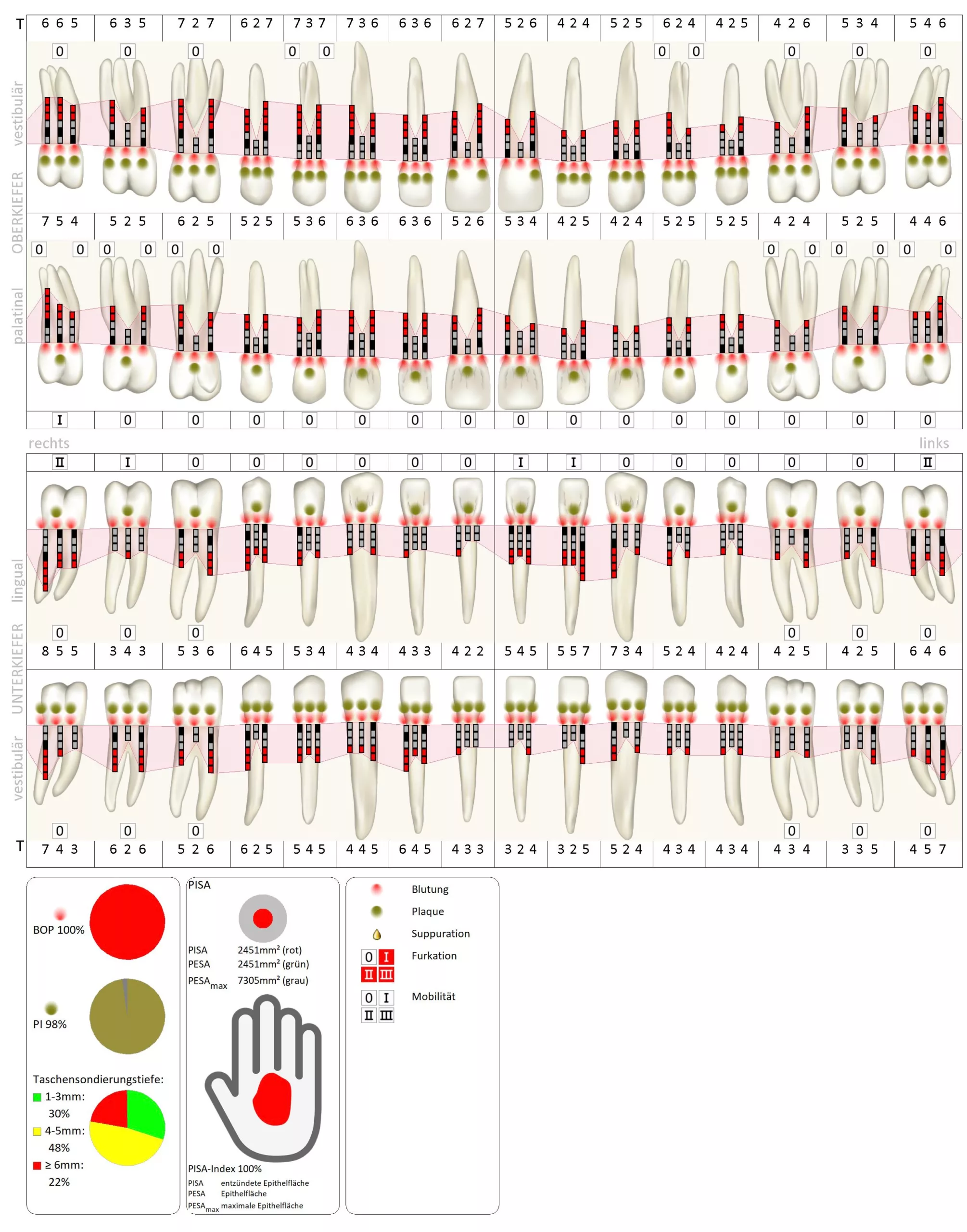 M. Cyris
M. Cyris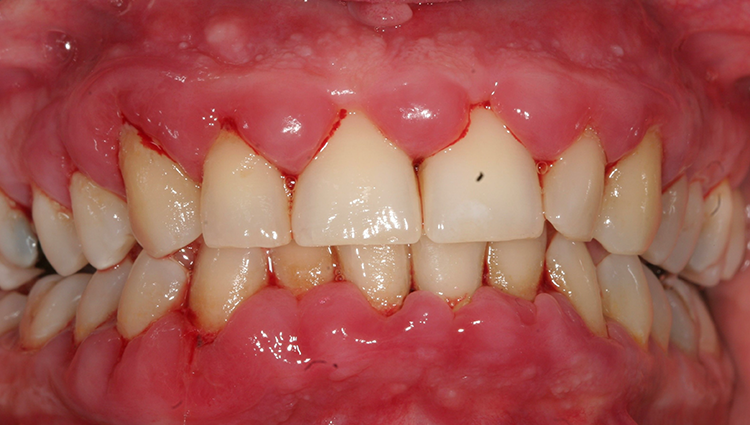 M. Cyris
M. Cyris
Es zeigte sich klinisch eine massiv hyperplastisch geschwollene und gerötete, teilweise flottierende Gingiva v.a. im Ober- und Unterkiefer-Frontzahnbereich. Zusätzlich traten spontan an diversen Stellen Blutungen auf. Plaque und mineralisierte Beläge waren generalisiert vorhanden, sodass die Mundhygiene als verbesserungswürdig bezeichnet werden konnte (Abb. 2).
 M. Cyris
M. Cyris
Therapie
Im ersten Therapieschritt fand neben einer professionellen mechanischen Plaquereduktion (PMPR) der supragingival erreichbaren Beläge eine ausführliche Instruktion zur patientenindividualisierten häuslichen Mundhygiene statt. Die Patientin wurde in der systematischen Nutzung der Handzahnbürste geschult und ihr wurde zur selektiven Reinigung der Zähne und besonders der marginalen Bereiche unterhalb der hyperplastischen Gingiva eine Monobüschelbürste empfohlen (TePe Compact Tuft, TePe, Malmö, Schweden). Als zusätzliche adjuvante antibakterielle Maßnahme sollte die Patientin die häusliche Mundhygiene statt mit ihrer regulär genutzten Zahnpasta mit einem chlorhexidinhaltigen Gel (Chlorhexamed Mundgel 10 mg/g) für eine Woche durchführen.
Aufgrund der stark geschwollenen Papillen konnte innerhalb dieser ersten Sitzung noch keine Anpassung der Interdentalraumbürsten erfolgen. In den folgenden Sitzungen fand unter lokaler Betäubung die subgingivale Instrumentierung der Zähne mit erhöhten Taschensondierungstiefen ≥ 4 mm statt, zusätzlich erfolgte die sich wiederholende Instruktion und Motivation zur Nutzung von Interdentalraumbürsten an den sich schnell verändernden anatomischen Verhältnissen in den ISO-Größen 2, 4 und 5 (TePe Interdentalbürste, TePe, Malmö, Schweden).
 M. Cyris
M. Cyris
Diese erfolgte innerhalb der kommenden Wochen in der Klinik für Mund- Kiefer- und Gesichtschirurgie des UKSH. Am selben Tag wurde eine erneute supra- und subgingivale Reinigung aller Zähne mit Taschensondierungstiefen ≥ 4 mm durchgeführt. Weitere 4 Monate später fand eine erneute Befundaufnahme statt.
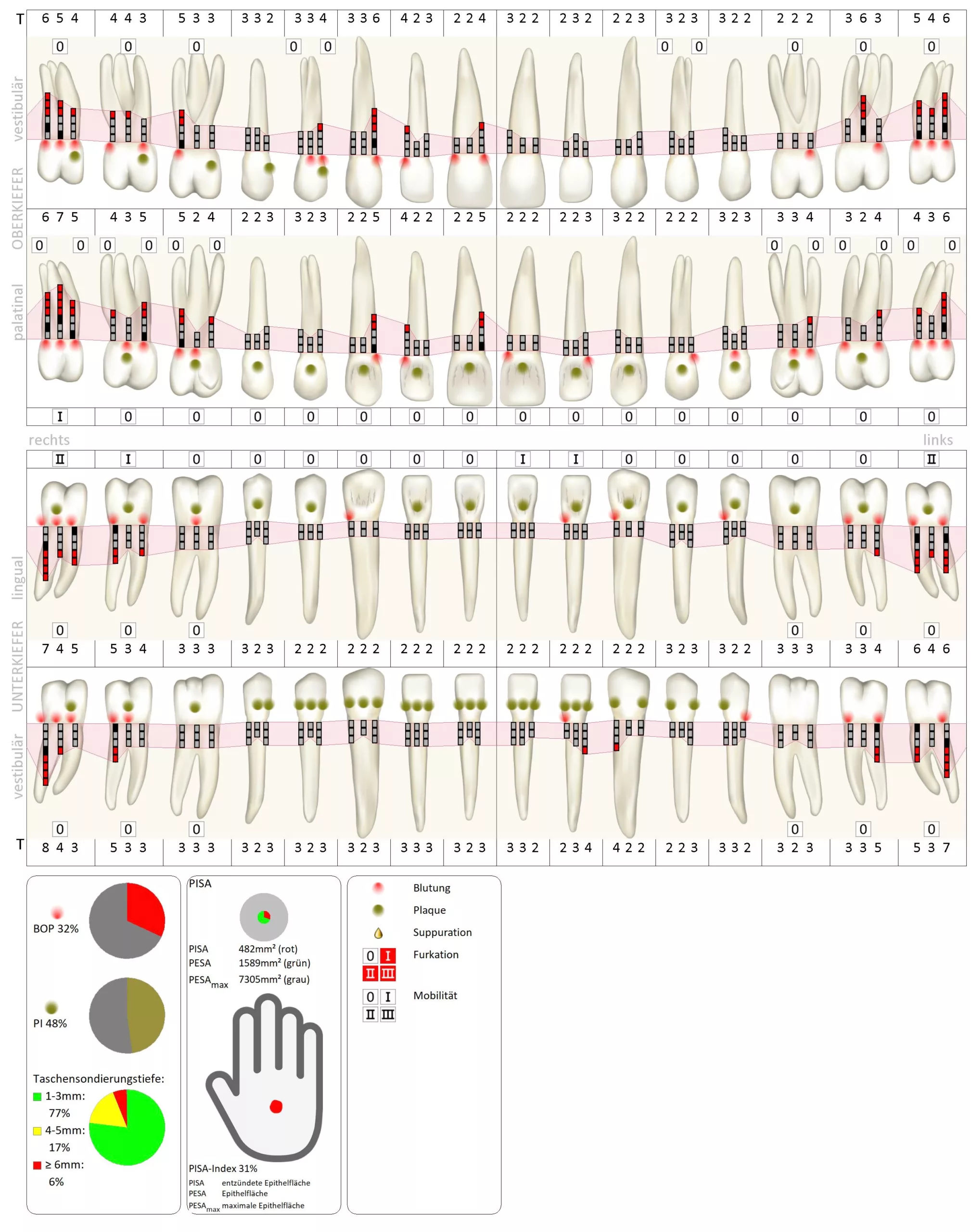
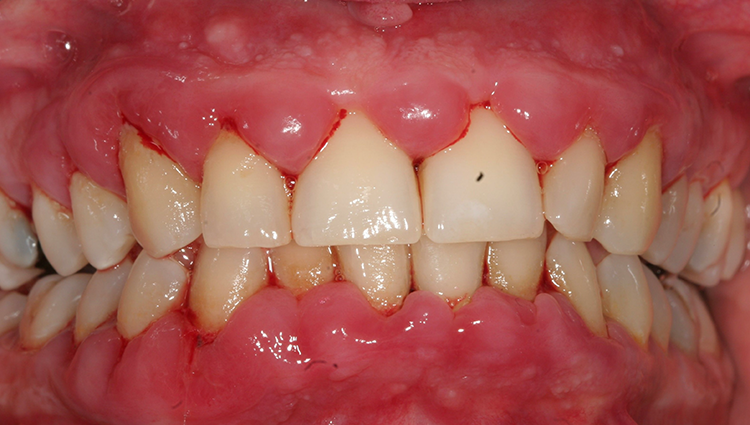
Bei diesem Termin konnten nur noch Taschensondierungstiefen von maximal 4 mm lokalisiert mit BAS festgestellt werden. Über den gesamten Behandlungszeitraum hatte sich der Plaque-Index von anfänglichen 98% auf 35% reduziert (Abb. 5). Klinisch war die Gingiva nun deutlich abgeschwollen, die Papillen füllten teilweise die Interdentalräume nicht mehr vollständig aus; weder eine Überlappung der Zahnkronen noch eine spontane Blutungsneigung waren feststellbar (Abb. 6).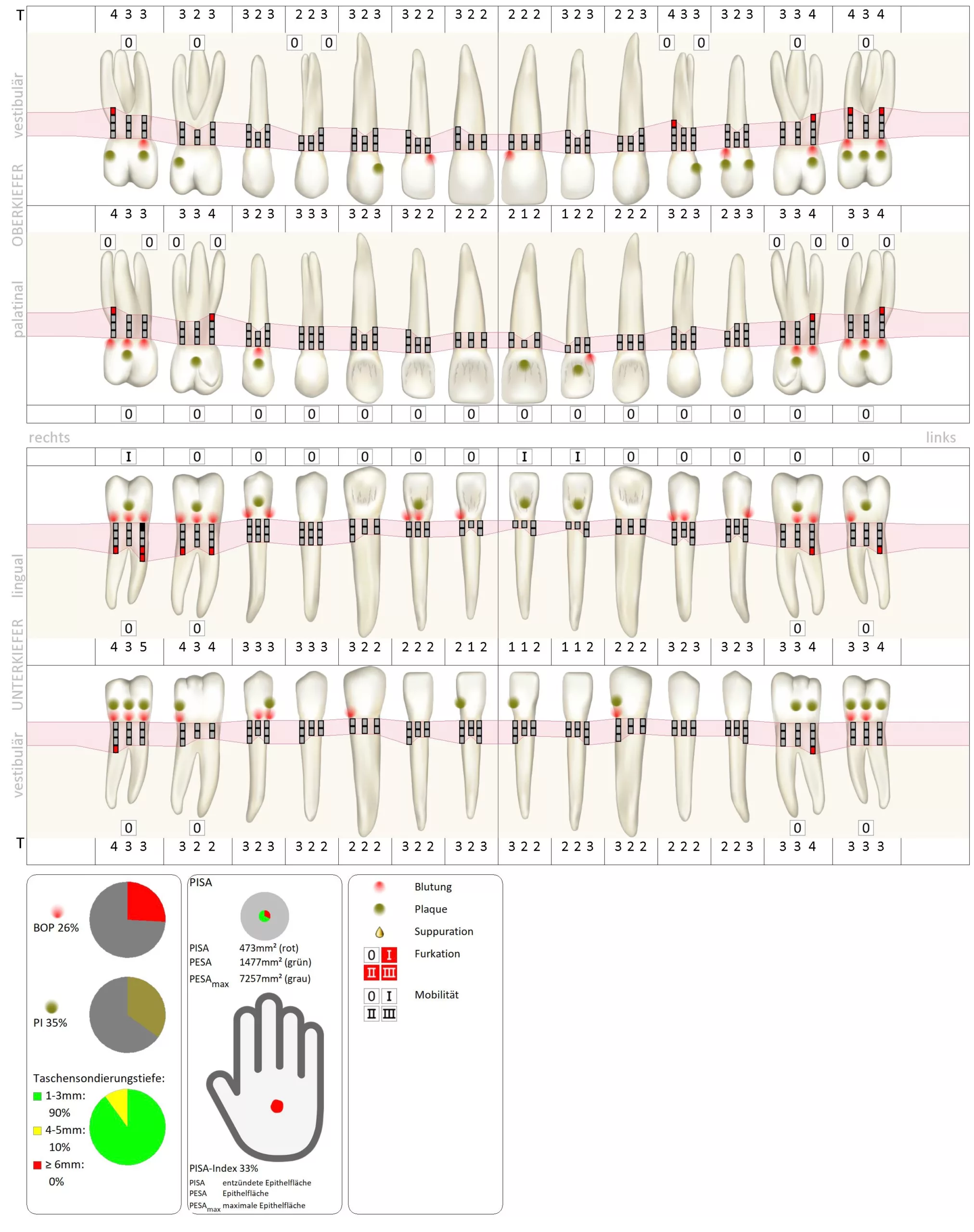 M. Cyris
M. Cyris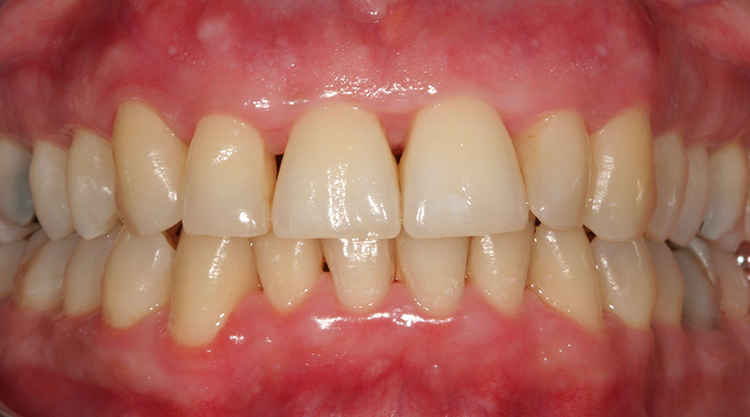 M. Cyris
M. Cyris
Die Patientin war mit dem Ergebnis sehr zufrieden. Die häusliche Mundhygiene war indessen wieder suffizient möglich. Auf weiterführende Maßnahmen, wie eine Biopsie zur Diagnosesicherung, eine Evaluation, ob eine Umstellung der Medikation durch den Hausarzt möglich ist, und auf ein weiterführendes chirurgisches Vorgehen konnte verzichtet werden.
Ab Januar 2023 schloss sich dann die unterstützende Parodontitistherapie (UPT) im Rahmen der PAR-Behandlungsstrecke mit einem 6-monatigen Intervall an. Bei weiterhin guter häuslicher Mundhygiene und Adhärenz zu den patientenindividuellen Nachsorgeterminen ist auch in Zukunft von einer stabilen parodontalen Situation auszugehen.
Diskussion
MIGH-Screening: regelmäßige Anamnese, parodontale Befunderhebung
Die arterielle Hypertonie ist die Krankheit mit der zweithöchsten Krankheitslast in Deutschland [25]. Nicht jede therapiebedürftige Hypertonie wird mit potenziell MIGH-auslösenden Medikamenten behandelt, jedoch machen Kalziumantagonisten etwa ein Viertel aller Verordnungen in diesem Bereich aus [21]. Zwar sind sowohl Zahnärztinnen und Zahnärzte als auch Mediziner und Medizinerinnen vom Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) dazu aufgerufen, Nebenwirkungen von Arzneimitteln zu melden, dennoch gibt es in Deutschland keine Statistiken zur Inzidenz der MIGH, sodass sich auch nicht ableiten lässt, wie weit das Gesundheitssystem bzw. die Zahnärzteschaft mit dem Krankheitsbild konfrontiert ist.
Um Patientinnen und Patienten mit MIGH oder entsprechende Risikopatienten aus dem eigenen Patientenklientel herauszufiltern, sollten einige Aspekte beachtet werden. Zum einen stellt die regelmäßige Erhebung einer aktuellen Anamnese einen wichtigen Pfeiler im Screening dar [5]. So gibt die Faustregel, 1-mal jährlich die Anamnese zu erheben bzw. zu aktualisieren, einen guten Anhaltspunkt.
Jedoch sollte bei älteren Patientinnen und Patienten, welche z.B. von einem Krankenhausaufenthalt berichten, die Anamneseerhebung bedarfsorientiert erfolgen, ggf. auch mehrfach im Jahr. Auch ist allgemein bekannt, dass die schriftlich ausgefüllten Anamnesebögen einen guten Leitfaden für das zwingend anzuschließende Anamnesegespräch bieten, dieses aber nicht ersetzen [26,27].
Im Rahmen des Patientengespräches sollten auch die Dosierung der genutzten Arzneimittel, aber auch mögliche Medikamentenkombinationen genauer hinterfragt werden. Patientinnen und Patienten, bei denen eine Polypharmazie vorliegt, können teilweise nicht alle eingenommenen Arzneimittel mit korrekten Namen benennen; in unklaren Fällen bietet sich die Rücksprache mit der Hausärztin bzw. dem Hausarzt oder dem behandelnden Internisten/der Internistin, der Fachärztin oder dem Facharzt an.
Ergibt die Anamnese, dass potenziell MIGH verursachende Medikamente eingenommen werden, sollte ein Augenmerk bei der sich anschließenden klinischen Untersuchung auf die Beschaffenheit des Zahnfleisches gelegt werden [21,28]. Wird ein PSI (parodontaler Screening Index) [29] durchgeführt, sollte immer kritisch hinterfragt werden, ob erhöhte Sondierungstiefen durch Pseudotaschen, welche durch die gingivalen Wucherungen entstehen können, oder echte parodontale Taschen durch Knochenverlust zustande kommen. Aber auch Kombinationen, wie im Fallbeispiel gezeigt, kommen vor.
Bei einem auffälligen PSI von Code 3 oder 4 sollte sich die Aufnahme eines vollständigen parodontalen Befundes anschließen [29]. Auch Reizfaktoren, wie überstehende Restaurationsränder, kariöse Läsionen, weit marginal liegende Retainer usw., die zu einer Plaqueakkumulation führen können, sollten berücksichtigt und ggf. beseitigt werden [30].
Patientinnen und Patienten, die aktuell keine Auffälligkeiten in Bezug auf die MIGH zeigten, sollten in Abhängigkeit vom Verordnungsbeginn des Arzneimittels oder der Arzneimittelkombination (s.o., Entstehung ca. 1 bis 3 Monate nach Ersteinnahme) [6] über das Risiko einer MIGH informiert und aufgeklärt werden. Zudem bietet es sich an, erneut die häusliche Mundhygiene mittels professioneller Instruktion und Motivation besonders im Bereich der Interdentalraumpflege zu optimieren, um ggf. begünstigende Faktoren einer gingivalen Entzündung zu reduzieren [30].
Gestaffeltes Vorgehen bei Interventionen
Bei Verdachtsdiagnose von MIGH folgt als nächster Therapieschritt die PMPR. Neben der Entfernung weicher und mineralisierter Beläge sollte der Schwerpunkt auf einer ausführlichen und patientenindividuellen Instruktion zur optimalen Mundhygiene sowie der Kontrolle von Risikofaktoren wie z.B. Rauchen liegen [8,22].
Für die Mundhygiene stehen neben mechanischen Hilfsmitteln, wie verschiedene Arten von manuellen oder maschinellen Zahnbürsten und von Interdentalraum-Pflegeprodukten wie Interdentalraumbürsten [31] oder elastische Interdentalraumsticks [32], auch chemische Hilfsmittel (chlorhexidinhaltige Spüllösungen oder Gelee, cetylpyridiniumchloridhaltige Spüllösungen, ätherische Öle) für eine zeitlich begrenzte Anwendung zur Verfügung [33]. Sollte sich neben der MIGH auch eine Parodontitis feststellen lassen, ist eine Integration der MIGH-Behandlung in die Parodontitistherapie gut möglich [30].
Lässt sich nach diesen ersten Interventionen keine Veränderung bzw. Besserung der MIGH-Ausprägung feststellen, sollte die primär gestellte (Verdachts-)Diagnose mittels weiterführender Diagnoseverfahren verifiziert werden. Dafür bietet sich eine Biopsieentnahme an. Laut aktueller S2k-Leitlinie [34] stellt eine Biopsie mit 2 bis 3 Wochen Verzögerung (Latenzzeit nach PMPR) noch keine statistisch signifikante Verschlechterung der Überlebensrate dar, sofern die Biopsie einen malignen Befund erbringt.
Somit kann argumentiert werden, dass durch dieses gestufte Vorgehen von niedrig zu höher invasiven Interventionen voreilige und damit unnötige Biopsien harmloser Schleimhautbefunde vermieden werden. Eine weitere allgemeinmedizinische Möglichkeit bietet eine Blutuntersuchung beim Hausarzt oder der Hausärztin, so können insbesondere Erkrankungen des blutbildenden Systems, wie z.B. eine Leukämie, ausgeschlossen werden [35].
Fazit
Zusammenfassend kann festgestellt werden, dass das heterogene klinische Erscheinungsbild der MIGH eine teils komplexe Diagnostik sowie interdisziplinäre Zusammenarbeit für eine erfolgreiche Therapie bedingt. So sollte das zahnärztliche Team bei Bedarf die Konsultation der Hausärztin bzw. des Hausarztes oder weiterführender Fachärztinnen und Fachärzte nicht scheuen [9,28] und gleichzeitig die Patientinnen und Patienten mit MIGH oder potenzielle Risikopatienten in ein individuelles Nachsorgekonzept einbinden [9,36]. Denn Patientinnen und Patienten, die ihre Nachsorgetermine einhalten und durch konsequente häusliche Mundhygiene für eine gute Biofilmreduktion sorgen, weisen eine bessere Remission der MIGH auf [21].
Näheres zu den Autoren des Fachbeitrages: Dr. Miriam Cyris, Dr. Christian GraetzBildquellen sofern nicht anders deklariert: Unternehmen, Quelle oder Autor/-in des Artikels
 Entdecke CME Artikel
Entdecke CME Artikel  Entdecke Artikel mit Download
Entdecke Artikel mit Download 
 Mit Google einloggen
Mit Google einloggen
 Mit Facebook einloggen
Mit Facebook einloggen




Keine Kommentare.