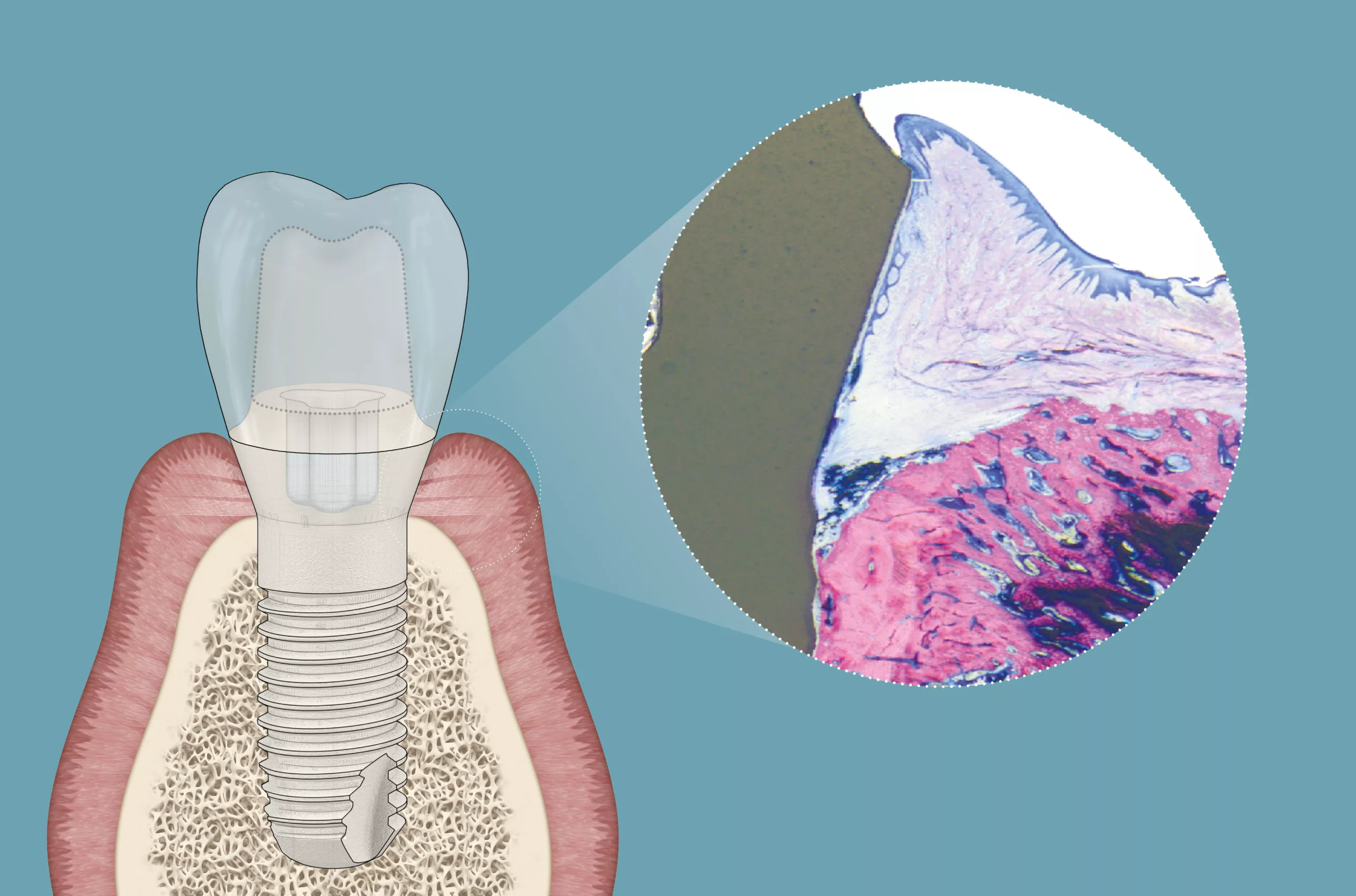
In der Literatur werden hohe Implantat-Überlebensraten von bis zu 97% bzw. 75% nach 10 [1] bzw. 20 Jahren [2] berichtet. Jedoch können auch bei guten Erfolgsraten Komplikationen auftreten. Die häufigste Komplikation, die zum Implantatverlust führen kann, ist die Periimplantitis [3]. Analog zur Gingivitis und Parodontitis entwickelt sich eine Periimplantitis immer aus einer periimplantären Mukositis heraus [4]. Während sich die periimplantäre Mukositis auf das umgebende Weichgewebe beschränkt, führt die Periimplantitis zu progressivem Knochenabbau um das Implantat herum [5]. Periimplantitis wurde von der EFP/AAP-Konsenskonferenz [6] als eine Biofilm-assoziierte Erkrankung des periimplantären Gewebes mit erhöhter Sondierungstiefe im Vergleich zu früheren Untersuchungen definiert.
Das Vorhandensein von Knochenverlust über initiale Knochenumbauvorgänge hinaus, Blutung bei Sondierung (BOP) oder Eiterabsonderung (SOP) bilden weitere Merkmale. Bei fehlenden Daten früherer Untersuchungen kann die Diagnose einer Periimplantitis auf der Kombination aus einem periimplantären Knochenverlust von ≥ 3 mm, Sondierungstiefen (PPD) von ≥ 6 mm und dem Vorhandensein von BOP oder SOP basieren [5]. Eine Metaanalyse schätzte eine mittlere Prävalenz von 22% (CI: 14,0–30,0%) für die Entwicklung der Erkrankung bei einem Implantatpatienten [7]. Risikofaktoren für Periimplantitis umfassen mangelhafte Mundhygiene, eine unbehandelte, aber auch bereits behandelte Parodontitis, Rauchen und systemische Erkrankungen, wie z.B. ein Diabetes [5]. Lokale prädisponierende Faktoren, wie eine falsche Implantatpositionierung, ungünstiges prothetisches Design und suboptimale Weichgewebequalität, müssen zudem angemessen berücksichtigt werden, um Komplikationen effektiv zu vermeiden [8].
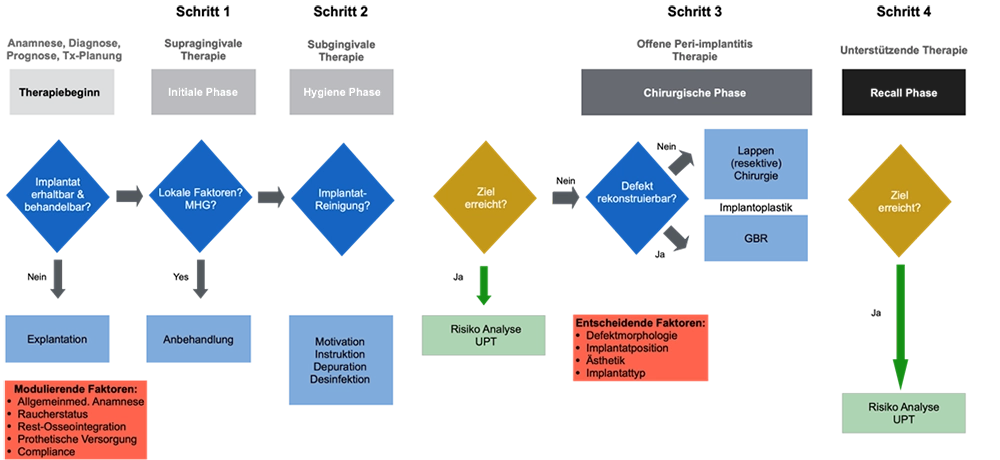
Rekonstruktiv vs. nichtrekonstruktiv
Für die Behandlung von Periimplantitis wurden verschiedene Modalitäten beschrieben [9]. Die frühzeitige Erkennung und Behandlung einer periimplantären Mukositis stellt eine zentrale Präventionsmaßnahme gegen Periimplantitis dar. Geht die Erkrankung bereits über eine Mukositis hinaus, sollte eine nichtchirurgische Therapie als erste Phase der Behandlung erfolgen, obwohl sich gezeigt hat, dass diese in den meisten Fällen aufgrund des begrenzten Zugangs zu den kontaminierten Oberflächen nicht vollständig wirksam ist [10]. Chirurgische Methoden hingegen scheinen bessere Ergebnisse zu erzielen [11]. In Bezug auf chirurgische Behandlungsoptionen wurden je nach Defektmorphologie rekonstruktive und nichtrekonstruktive Protokolle beschrieben [9]. Nichtrekonstruktive Verfahren umfassen die offene Kürettage (OFD) oder resektive Eingriffe, wie die Implantoplastik und Osteoplastik. Im Gegensatz zu ihnen umfassen rekonstruktive Modalitäten die Verwendung von Biomaterialien mit dem Ziel, den periimplantären Knochen wieder aufzubauen [12].
Therapieplanung: Defektklasse und weitere Faktoren berücksichtigen
Bei jeder chirurgischen Planung müssen zu Beginn individuelle Wirtsfaktoren und damit die Eignung eines jeden Patienten bzw. einer jeden Patientin für rekonstruktive und augmentative Therapien evaluiert werden. So haben systemische und Umweltfaktoren wie Rauchen, häusliche Mundhygiene und der allgemeinmedizinische Zustand einen entscheidenden Einfluss auf den Erfolg einer rekonstruktiven Therapie [6]. Es gilt, die Patientin bzw. den Patienten zuerst von möglichst vielen Risikofaktoren zu befreien, bevor chirurgische Maßnahmen ergriffen werden.
Darüber hinaus wird das Heilungspotenzial der rekonstruktiven Therapie hauptsächlich durch die Morphologie der zugrunde liegenden Knochendefekte bestimmt [13]. Schwarz und Mitarbeiter [14] untersuchten die verschiedenen Defektkonfigurationen. Während Klasse-I-Defekte gut definierte intraossäre Defekte mit einer zusätzlichen Unterklassifizierung umfassen, basierend auf den verlorenen Knochenwänden und ihrer Konfiguration, beschreiben Klasse-II-Defekte horizontale Knochenverluste. Innerhalb der Klasse-I-Defekte stellt die Ie-Konfiguration einen umlaufenden schüsselförmigen selbsterhaltenden Defekt dar und wurde als die günstigste Konfiguration für einen rekonstruktiven Ansatz definiert.
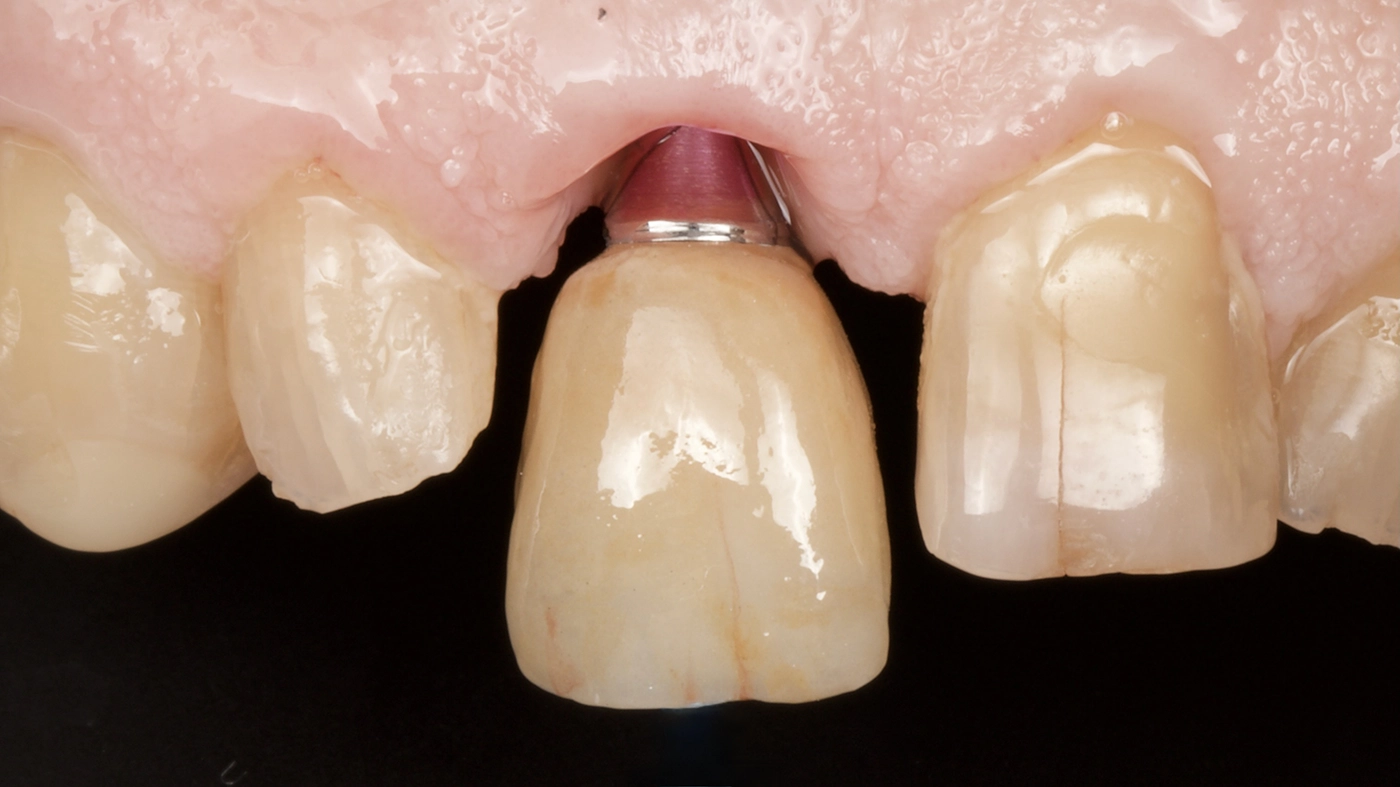
In Übereinstimmung mit der Morphologie parodontaler Defekte besteht die Annahme: Je mehr Wände vorhanden sind, desto höher ist das Potenzial zur Knochenrekonstruktion [15], da eine voraussagbare Stabilität des Blutkoagulums erreicht werden kann. Im Gegensatz zu dieser optimalen Situation scheint die Rekonstruktion von horizontalen Klasse-II-Defekten – wie bei parodontalen Defekten – keine Erfolgsaussichten zu haben [11]. Dies bedeutet, dass in kombinierten Klasse-I- und -II-Defekten freiliegende Implantatschultern und Gewindegänge nur durch nichtrekonstruktive oder möglicherweise resektive Mittel, d.h. Implantoplastik [16], beseitigt werden sollten. Eine Kombination eines resektiven Ansatzes mit geführter Knochenregeneration (GBR) kann also in Betracht gezogen werden, wenn Defekte sowohl horizontale als auch vertikale Komponenten aufweisen [16]. Abbildung 1 zeigt den klinischen Verlauf einer Periimplantitis-Behandlung.
 Schmidlin/Solderer/Liu
Schmidlin/Solderer/LiuKlinische Durchführung: Dekontamination und gesteuerte Knochenregeneration
Einer jeden chirurgischen Intervention geht eine nichtchirurgische Therapie voraus. Darauf sollte bei Persistenz der Problematik chirurgisch interveniert werden. Rekonstruktive chirurgische Eingriffe sollten erst ab vertikalen Defekten von mindestens 3 mm angedacht werden. Die Prothetik sollte, sofern möglich, für den Eingriff abgenommen werden, um einen besseren Zugang zu gewährleisten [17].
In der Literatur werden verschiedene Dekontaminationsmethoden mit mechanischen und chemischen Ansätzen und Kombinationen beschrieben [18,19]. Diese reichen von Ultraschall- und Pulver-Wasserstrahl-Geräten, Bürsten- und Laserverfahren bis hin zu elektrochemischen Verfahren. Alle Methoden zielen im Allgemeinen darauf ab, Biofilm und/oder Zahnstein zu entfernen und eine biokompatible Oberfläche zu schaffen, was konzeptionell zu einer erfolgreichen Reosseointegration führt [20]. Trotz verschiedener Materialien und Protokolle scheint bis dato keines in der Lage zu sein, die Implantatoberflächen vollständig und zuverlässig zu dekontaminieren [21]. Daher stellen die meisten Protokolle eine Kombination aus mechanischen und chemischen Debridementmethoden dar, die die vermeintlichen Vorteile jedes Ansatzes kombinieren [19].
Knochenersatzmaterialien und Membranen sollten zur Rekonstruktion des Knochendefektes verwendet werden [17]. In selbsterhaltenden Defekten kann jedoch auf Membranen verzichtet werden [22]. Die Wundstabilität und die Stabilisierung des chirurgischen Lappens sind von entscheidender Bedeutung [15], um die wesentlichen biologischen Prinzipien und Bedingungen zu erfüllen: eine Platzhalterfunktion, die Wundstabilität und die Heilung durch primäre Intention [15]. Hinsichtlich der Heilungsmethoden besteht kein Konsens darüber, ob eine gedeckte oder eine transgingivale Heilung zu besseren Ergebnissen führt. Bezüglich einer systemischen und lokalen Antibiose gibt es ebenfalls keine eindeutigen Empfehlungen [17].
Partielle Defekt-Rekonstruktion als wahrscheinlicher Therapieerfolg
Eine systematische Übersichtsarbeit [23] zeigte nur in etwa 10% der Fälle eine vollständige Knochenfüllung nach rekonstruktiven Eingriffen, während eine teilweise Knochenfüllung in fast 86% und keine Knochenfüllung in 4% beschrieben wurde. Daher muss man derzeit von einer nur partiellen Rekonstruktion des Defekts ausgehen [23]. In einer aktuelleren systematischen Überprüfung wurden nach einem Jahr ein zusätzlicher mittlerer Knochengewinn von ca. 1,7 mm und eine um 57% höhere Defektfüllung beobachtet, wenn rekonstruktive Verfahren mit einer offenen Lappenchirurgie (OFD) verglichen wurden [24].
Eine kürzlich durchgeführte systematische Überprüfung ergab keine Überlegenheit rekonstruktiver Therapien gegenüber einer offenen Kürettage (OFD) hinsichtlich der Reduktion klinischer Entzündungsparameter wie Sondierungstiefen (PPD), Blutung auf Sondieren (BOP) und Suppuration (SOP) über einen Zeitraum von 12 Monaten [25]. Eine weitere Metaanalyse kam zum selben Schluss und untersuchte darüber hinaus die Verlustrate von Implantaten nach Periimplantitistherapie [18]. Zwölf Monate nach Chirurgie konnte kein signifikanter Unterschied zwischen rekonstruktiver und nichtrekonstruktiver Therapie (1% vs. 2%) beobachtet werden. Nach 3 Jahren zeigten rekonstruktive Behandlungsansätze im Vergleich zu nichtrekonstruktiven Verfahren jedoch signifikant weniger Implantatverluste (1% vs. 8%) [18]. Auch wenn eine chirurgische Behandlung von periimplantären Läsionen durchgeführt wird, können nach der Behandlung biologische Komplikationen auftreten, die letztendlich zu einem vollständigen Implantatversagen und folglich zur Entfernung des Implantats führen können [3].
Prognostische Faktoren für den Therapieerfolg
Ichioka und Mitarbeiter kamen zu dem Schluss, dass tiefere Defekte und höhere Sondierungstiefen bei Beginn der Therapie zu einer höheren Tendenz zu unvollständiger Heilung oder Implantatversagen führten [26]. Ähnliches beobachteten Ravidà und Mitarbeiter in einer Studie, um mögliche prognostische Faktoren für den Implantatverlust nach chirurgischer Periimplantitistherapie zu erfassen [27]. Über eine Beobachtungszeit von 42,6 (SD: 26,3) Monaten wurden 18% der behandelten Implantate entfernt. Frontzahnimplantate wurden häufiger entfernt als Implantate im Seitenzahnbereich. Zudem beeinflusste der prozentuale anfängliche marginale Knochenverlust (MBL) den Erfolg der Periimplantitischirurgie und damit die Überlebensrate. Ein MBL zwischen 25% und 50% der Implantatlänge zu Beginn zeigte ein 15-fach höheres Risiko für ein Versagen im Vergleich zu Implantaten mit weniger als 25% MBL. Ein MBL über 50% zeigte ein 20-fach höheres Risiko für ein Therapieversagen.
Eine Umfrage in deutschen Implantatpraxen ergab, dass Implantate durchschnittlich bei einem Knochenverlust von ca. zwei Dritteln als gescheitert betrachtet und entfernt werden [28]. Obwohl einige Studien über Implantatentfernungen berichten, gibt es keine klaren Richtlinien, ob und wann ein infiziertes Implantat behandelt oder explantiert werden sollte. Jedoch sollte basierend auf den vorliegenden Daten eine Explantation bei mehr als 50% Knochenverlust erwogen werden. Die erneute Implantation in eine Region, in der ein Implantat bereits verloren ging, birgt eine Überlebensrate für das neue Implantat von 71 bis 100% über einen Zeitraum von 5 Jahren [3].
War eine rekonstruktive Therapie erfolgreich, so geht der Patient bzw. die Patientin in die unterstützende parodontale/periimplantäre Therapie (UPT) über. Regelmäßige Recall-Sitzungen (dreimal pro Jahr) nach rekonstruktiver Chirurgie wurden als positiv für den Langzeiterfolg beschrieben [27]. Zugleich wurde für Patientinnen und Patienten, die dem Recall-Plan nicht folgten, eine niedrigere Überlebensrate nach rekonstruktiver Therapie beschrieben [29]. Tatsächlich beschrieben Hwang und Mitarbeiter [30] die mangelnde Patienten-Compliance nach Chirurgie als zusätzliches großes Risiko für Implantatversagen nach Therapie.
Fazit
Periimplantitis stellt kein seltenes Problem in der täglichen Praxis dar. Ein probates Allheilmittel scheint noch nicht gefunden. Wann immer möglich und sinnvoll sollten jedoch rekonstruktive Verfahren angewandt werden, um die bestmögliche Überlebenschance des Implantates zu garantieren. Verschiedene individuelle Faktoren sollten vor dem Eingriff evaluiert werden.
 Entdecke CME Artikel
Entdecke CME Artikel  Entdecke Artikel mit Download
Entdecke Artikel mit Download 



 Mit Google einloggen
Mit Google einloggen
 Mit Facebook einloggen
Mit Facebook einloggen
Keine Kommentare.