|
Getting your Trinity Audio player ready...
|
- Teil 1
- Historischer Rückblick: „Ein Mausoleum aus Gold…“
- Kausalität versus Assoziation
- Bakteriämie
- Parodontitis apicalis
- Koronare Herzerkrankungen
- Diabetes
- Entzündliche Darmerkrankungen
- Lebererkrankungen
- Rheumatische Erkrankungen
- Autoimmunerkrankungen
- Teil 2
- Endodontie und Erkrankungen des hämatopoetischen Systems
- Leukämie und Lymphome
- Hämophilie
- Sichelzellanämie
- Patienten/-innen mit Stammzelltransplantation
- Viruserkrankungen
- Endodontie und Osteoporose
- Allergien
- Latex
- Guttapercha
- Natriumhypochlorit (NaOCl)
- Chlorhexidin
- Nickel-Titan-Instrumente
- (Para)formaldehyd
- Medikamentöse Einlagen
- Wurzelkanalfüllmaterialien
- Fazit
Teil 1
Bedingt durch das zunehmende Durchschnittsalter der Bevölkerung nimmt auch in der Zahnarztpraxis die Zahl der Patientinnen und Patienten mit Einschränkungen der Allgemeingesundheit, Gelenkersatz, Organersatz, chronischen Erkrankungen und Dauermedikationen zu. Viele häufig vorliegende Erkrankungen und Einschränkungen müssen ebenso wie Medikationen aufgrund möglicher negativer Wechselwirkungen auch bei endodontischen Behandlungen berücksichtigt werden. Dies gilt auch für gesundheitsbeeinflussende oder -modifizierende Faktoren wie Schwangerschaft, Alter, Allergien, Ernährung, Alkohol oder Rauchen.
Historischer Rückblick: „Ein Mausoleum aus Gold…“
Die erste Erwähnung einer Fokalinfektion wird Hippokrates (460–370 v. Chr.) zugeschrieben, der die Heilung eines von Arthritis befallenen Patienten auf eine Zahnextraktion zurückführte. Letztlich eingeläutet wurde die Ära der Fokalinfektion durch einen Vortrag, den William Hunter an der Fakultät für Medizin der McGill University in Montreal am 3. Oktober 1910 hielt und als „Hunter‘s address“ in die Geschichte der Endodontie einging. Hunter behauptete, „Goldfüllungen, Goldbrücken, Goldkronen, festsitzende Zahnprothesen, die in, an und um kranke Zähne herum gebaut sind, bilden ein wahres Mausoleum aus Gold über Massen von Sepsis, zu der es im gesamten Bereich der Medizin oder der Chirurgie keine Parallele gibt. Das Ganze stellt eine perfekte Goldfalle der Sepsis dar, auf die der Patient sichtlich stolz ist und von der ihn kein Argument überzeugen wird sich zu lösen, da es ihn viel Geld gekostet hat und er eher stolz darauf ist, wie seine schwarzen Wurzeln elegant mit geschmiedetem Gold abgedeckt worden sind. Die schlimmsten Fälle von Anämie, Gastritis, unklarem Fieber, Nervenerkrankungen aller Art, chronischen rheumatischen Erkrankungen, Nierenkrankheiten, sie alle haben ihren Ursprung in oder werden verstärkt durch orale Sepsis, verursacht durch diese Goldfallen der Sepsis…“.
Dr. Frank Billings empfahl konsequenterweise die Entfernung aller Infektionsherde, insbesondere der Zähne und Tonsillen. Er meinte, dass„diese Maßnahmen alleine den weiteren Verlauf der Krankheit aufhalten und normalerweise eine vollständige Genesung stattfinden wird“. Billings beschrieb als Erster in einer Falldarstellung, dass aus einer septischen Arthritis kultivierte Mikroorganismen nach intravenöser Injektion in ein Kaninchen dort ebenfalls eine Arthritis induzierten. Rosenow und Billings entwickelten das Konzept der „elektiven Lokalisation“ und der „Transmutation“. Sie waren der Überzeugung, dass Bakterien eine bestimmte Affinität zu jeweils bestimmten entfernten Körperregionen oder Organen hätten, was zu einem vom ursprünglichen Infektionsort entfernten Krankheitsprozess an diesen spezifischen Lokalisationen („elective localization“) führte. Hierbei könnten die Mikroorganismen ihre Eigenschaften und biologischen Charakteristika ändern („Transmutation“). Diese „Transmutationstheorie“ wies den Vorteil auf, dass sie eine gute Erklärung dafür bot, dass andere Forschungsgruppen Rosenows Ergebnisse nicht reproduzieren konnten.
In der ersten Hälfte des 20. Jahrhunderts wurden die Zähne als Sitz einer potenziellen fokalen Infektion für zahlreiche Krankheitsprozesse im ganzen Körper verantwortlich gemacht, wie z.B. Augenerkrankungen, Arthritis, Mandelentzündungen, Magengeschwüre, Gallenblasenentzündungen, Myositis, Diabetes und viele andere nicht erklärbare, unbekannte oder vage systemische Zustände. Die praktischen Konsequenzen: Millionen von Zähnen und Tonsillen wurden entfernt, es kam zu einer „orgy of extractions“, die „100 percenters“ extrahierten alle wurzelkanalbehandelten Zähne und die eher präventiv orientierten Zahnärzte/-innen entfernten sicherheitshalber gleich alle Zähne („clean sweep“, „therapeutic edentulation“). Es wurde tatsächlich empfohlen, „nahezu kriminelle Kollegen“, die trotzdem noch Wurzelkanalbehandlungen vornahmen, mit „6 months hard labor“ zu bestrafen. Aber auch zahlreiche konsekutive Eingriffe wie Darmspülungen oder Operationen (und Entfernungen) innerer Organe wurden vorgenommen. Im amerikanischen Journal of Ophthalmology wurde die Befürchtung geäußert: „Stripped of tonsils and teeth, often the victim of colonic irrigation, abdominal, and genito-urinary operations, the patient may finally be reduced to those organs necessary for existence, while all the time his ocular disease progresses remorsely to blindness.“
Welche Exzesse auf der Theorie der Fokalinfektion basierten, verdeutlicht das Beispiel des Arztes Henry A. Cotton. Cotton, von 1907 bis 1930 Direktor einer Nervenheilanstalt (Trenton State Hospital, USA), identifizierte dentale Foki als Ursache von Schizophrenie (Dementia praecox) und manischer Depression (bipolare Störungen). Er forderte die Entfernung aller restaurierten Zähne und die Entfernung aller festsitzenden Restaurationen, obwohl er zugab, dass 5% von guter Qualität waren; es sei aber zu riskant, diese Arbeiten und Zähne zu belassen. Den Patienten/-innen seiner Klinik wurden ab 1918 routinemäßig alle Zähne entfernt, um die Heilung der Nervenerkrankungen zu fördern. In den folgenden Jahren erweiterte Cotton sein Vorgehen und empfahl zusätzlich die chirurgische Sanierung der Kieferhöhlen und die Entfernung der Tonsillen. Häufig wurde zusätzlich die Entfernung von Blinddarm, Gallenblase, Milz, Magen, Kolon, Zervix und/oder Ovarien und Hoden vorgenommen. Mehr als 200 Patienten/-innen erlitten diese Prozeduren („experimental surgery as psychiatric treatment“). Die angebliche 85%ige Heilung der Nervenerkrankungen ist jedoch nirgendwo dokumentiert, die Mortalitätsrate soll bei 30% der Patienten/-innen gelegen haben.
 Screenshot © Hülsmann
Screenshot © Hülsmannwieder aufgewärmt. Empfohlen wurde am Ende der Ersatz pulpaentzündeter und wurzelkanalbehandelter Zähne durch Keramikimplantate.
Die Qualität und der Erfolg sowohl nicht chirurgischer als auch chirurgischer endodontischer Behandlungen in der Zahnarztpraxis begannen im Laufe der Jahre die Theorie der Fokalinfektion in den Hintergrund zu drängen. In Europa wurden derartige Theorien ebenfalls heftig und kontrovers in der zahnärztlichen Fachliteratur diskutiert, erlangten aber erfreulicherweise nie die überragende Bedeutung, die sie in den USA hatten. Unterschiedlich große Fragmente dieser Theorien finden sich allerdings auch heute noch im Umfeld der sogenannten „Ganzheitlichen Zahnmedizin“ [1,2] und sorgten vor wenigen Jahren nach Erscheinen eines reißerischen Videos mit dem Titel „Root Cause“ für vorübergehende Aufregung (Abb. 1), in dem Zähne mit apikalen Entzündungen und Wurzelkanalbehandlungen u.a. für ein Burnout und erektile Dysfunktion verantwortlich gemacht und deren Entfernung und Ersatz durch Keramikimplantate empfohlen wurde [1].
Kausalität versus Assoziation
Vor allem für die Parodontologie sind zahlreiche Interaktionen zwischen parodontalen Erkrankungen und systemischen Erkrankungen nachgewiesen. Vergleichbare umfangreiche Daten liegen für die Endodontie bislang nicht vor, in zahlreichen Studien und Übersichtsarbeiten wurde aber mittlerweile die Thematik „Endodontie und Allgemeingesundheit“ aufgegriffen, jetzt aber auf der Grundlage fundierter, wissenschaftlich gesicherter Daten. Einige Erkrankungen (Diabetes, Osteoporose) oder andere systemische Faktoren (z.B. Rauchen) können durchaus auch die Gesundheit der Pulpa tangieren und/oder Erkrankungs- und Heilungsvorgänge im Pulpagewebe und im apikalem Parodont beeinflussen, umgekehrt können aber auch Pulpaerkrankungen Allgemeinerkrankungen wie z.B. koronale Herzerkrankungen (KHK), Diabetes mellitus (DM), Darmerkrankungen, Lebererkrankungen, Erkrankungen des rheumatischen Formenkreises u.a.m. negativ beeinflussen.
Im Gegensatz zur Theorie der sogenannten „Herdlehre“ aus den 30er-Jahren, liegen heute keine Hinweise auf eine kausale Fernwirkung endodontischer Erkrankungen vor. Für eine Kausalität müssen mindestens zwei Bedingungen erfüllt sein: 1. B (Effekt) folgt immer auf A (Ursache). 2. Falls A nicht auftritt, tritt B nicht auf (A ist die notwendige Ursache [„necessary cause“ ]) [3]. Es handelt sich bei den im Folgenden vorgestellten Zusammenhängen und Wechselwirkungen um Assoziationen, also ein- oder gegenseitige Beeinflussungen, meist Verstärkungen oder Modulationen des jeweiligen Krankheitsverlaufes. Aus therapeutischer Sicht bedeutet dies, dass präventive oder kurative endodontische Maßnahmen sich positiv auf den Verlauf von Allgemeinerkrankungen auswirken können und ein positiver Verlauf von systemischen Problemen die Inzidenz, die Ausprägung und die Prognose endodontischer Erkrankungen verbessern kann. Eine enge Kooperation zwischen Allgemein- und Hausärzten bzw. Spezialisten und (nicht nur) endodontisch tätigen Zahnärzten wird in Zukunft daher eine deutliche wichtigere Rolle spielen (Abb. 2 und 3).
Bakteriämie
Die zentralen Verbindungen zwischen Endodont und anderen Körperregionen verlaufen über die Bakteriämie, die „Ausstreuung“ von Mikroorganismen über den Blutweg, und die Freisetzung proinflammatorischer Zytokine, die Organ-, Gewebe- und Knochenstoffwechsel beeinflussen können. Bei jeder endodontischen Behandlung kommt es innerhalb kürzester Zeit, d.h. weniger Sekunden, zu einer geringfügigen Bakteriämie (< 10 CFU/ml), die den zahnärztlichen Eingriff aber nur ca. 15 bis 30 Min. überdauert. Bei Überinstrumentierung fällt das Ausmaß der Bakteriämie größer aus. Die Zahl der apikal in das Blut übergetretenen Mikroorganismen ist abhängig von der Größe des Foramens, dem Ausmaß der Infektion des Endodonts und der Art der Wurzelkanalbehandlung, d.h. bei vitaler Pulpa geringer als bei nekrotischer Pulpa [4].
Auch die Behandlungstechnik spielt eine wichtige Rolle: In zahlreichen Studien wurde gezeigt, dass eine Instrumentation eines Wurzelkanals ohne apikale Extrusion von Debris – und damit auch von Mikroorganismen – faktisch unmöglich ist. Eine Reihe oraler Mikroorganismen, die bei infektiöser Endokarditis gefunden wurden, wurden auch schon aus infizierten Wurzelkanälen und apikalen Läsionen isoliert. Diese zirkulierenden Mikroorganismen können sich insbesondere an vorgeschädigten Körpergeweben anlagern und systemische Probleme modulieren oder verstärken: Die bakterielle Endokarditis ist das bekannteste Beispiel, aber auch Implantate, z.B. Hüft- oder Kniegelenkprothesen, bieten aufgrund ihrer Flächenausdehnung große Anlagerungsflächen.
Eine präventive antibiotische Abschirmung ist aber dennoch nur in Ausnahmefällen bei Personen mit erhöhtem Risiko, darunter eingeschränkte Immunfunktion, erhöhtes Endokarditisrisiko, Bestrahlungstherapie, Dialyse, Bisphosphonatmedikation, notwendig und indiziert: Antibiotikum der ersten Wahl ist Amoxicillin [5].
Parodontitis apicalis
Eine Parodontitis apicalis stellt eine durch intrakanaläre Mikroorganismen und deren Abbauprodukte induzierte reaktive periradikuläre Knochenresorption dar. Die Freisetzung proinflammatorischer Enzyme setzt im periapikalen Gewebe und auch darüber hinaus komplexe Änderungen physiologischer Stoffwechselvorgänge in Gang, die wiederum vielfältige Konsequenzen haben können:
- Eine Metaanalyse auf der Basis von 15 Studien mit insgesamt 1.087 Patienten/-innen und 2.226 wurzelkanalgefüllten Zähnen wies nach, dass Letztere bei Diabetikern/-innen etwa 3,4-mal häufiger mit einer apikalen Parodontitis assoziiert sind als bei gesunden Patienten/-innen [6].
- Im Pulpagewebe von Diabetikern/-innen liegen erhöhte iNOS-Aktivitäten (inducible NO synthase) und SOD-Aktivitäten (superoxide dismutase) vor [7,8]. Dabei weist die Expression von iNOS auf vorliegende entzündliche Prozesse und die gesteigerte SOD-Aktivität auf einen erhöhten oxidativen Stress im Pulpagewebe hin. Dieser gesteigerte oxidative Stress kann durch einen reduzierten Melatoninspiegel im Pulpagewebe von Diabetikern erklärt werden [9], da Melatonin einen antioxidativen und entzündungshemmenden Effekt im Pulpagewebe ausübt.
- Gomes et al. wiesen nach, dass eine apikale Parodontitis die systemischen Konzentrationen entzündlicher Zytokine deutlich erhöhen kann [10].
Koronare Herzerkrankungen
Einige Studien haben in den letzten Jahren Interaktionen zwischen endodontischer Pathologie und koronaren Herzerkrankungen aufgezeigt, wobei in diesem Fall die endodontische Erkrankung die systemische Erkrankung beeinflusst:
- Es besteht eine Korrelation zwischen dem Vorliegen einer apikalen Parodontitis und einer erhöhten Blutkonzentration von Entzündungsmarkern [11].
- Patienten/-innen mit einer apikalen Parodontitis haben ein 1,4- bis 5-fach höheres Risiko, eine kardiovaskuläre Erkrankung zu entwickeln, als Patienten/-innen ohne apikale Parodontitis [12]. In einer weiteren Studie wurde das Risiko mit 2,8-fach berechnet [13].
- Eine Hypertonie ist mit einem etwa 2,3-fach erhöhten Risiko für die Entstehung eines periapikalen Abszesses assoziiert, Patienten/-innen mit durchgemachtem Infarkt weisen ebenfalls ein höheres Abszessrisiko auf (1,4% zu 0,6%) [14].
- Die Summe aus wurzelkanalbehandelten Zähnen und apikalen Läsionen („endodontische Belastung“) ist ein Prädiktor für zukünftige kardiovaskuläre Ereignisse [10,15].
- Wie eine systematische Übersicht zeigt, weisen 18 von 23 ausgewerteten Studien eine Assoziation zwischen Parodontitis apicalis und koronaren Herzerkrankungen nach [12].
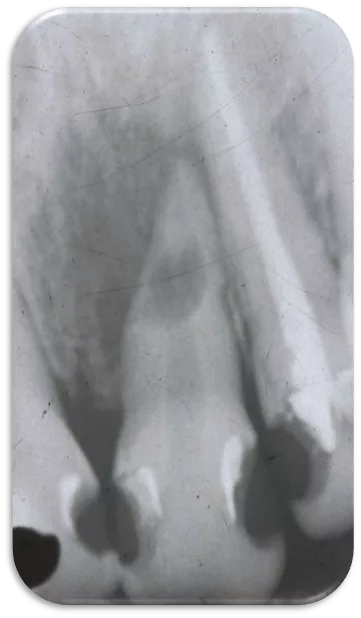
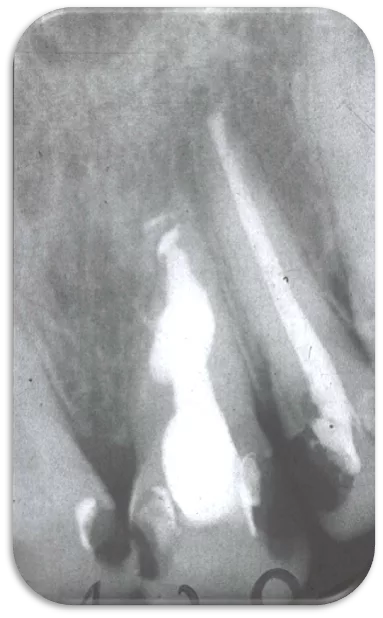
- Multiple Zähne mit Dentikeln können ein Indikator für das Vorliegen koronarer Herzerkrankungen sein [16] (Abb. 4a bis d).
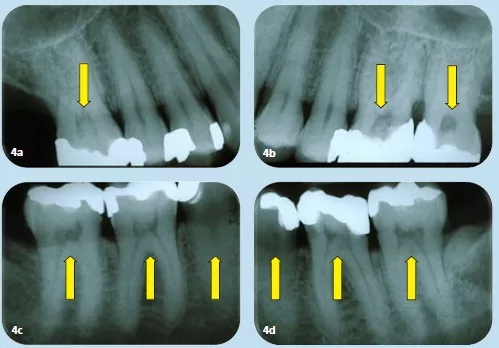 Hülsmann / Schäfer
Hülsmann / SchäferUmgekehrt kann sich aber eine sorgfältig durchgeführte Wurzelkanalbehandlung positiv auf das Herz-Kreislauf-System auswirken:
- Durch eine Wurzelkanalbehandlung können die Serumkonzentrationen inflammatorischer Zytokine wieder auf Normwerte zurückgeführt und damit das Risiko koronarer Herzerkrankungen reduziert werden [17,18].
- Das Risiko, eine koronare Herzerkrankung zu entwickeln, ist bei Patienten/-innen mit abgeschlossener Wurzelkanalbehandlung im Vergleich zu denjenigen mit nicht abgeschlossener Wurzelkanalbehandlung um 84% verringert und das Risiko, an einer koronaren Herzerkrankung zu versterben, um 49% verringert [19].

Diabetes
Diabetes mellitus (DM) ist eine chronische Stoffwechselkrankheit, die weltweit bis zu 6% oder mehr der Bevölkerung betrifft. Mehr als 70% der Betroffenen sind älter als 50 Jahre, Männer sind häufiger betroffen als Frauen. Die Mortalitätsrate liegt etwa doppelt so hoch wie für Nichtbetroffene, schwere Begleit- oder Folgeerkrankungen wie Myokardinfarkte, Erblindung, Amputationen und terminales Nierenversagen sind keine Seltenheit. Über Assoziationen zwischen DM und endodontischen Erkrankungen liegen mittlerweile zahlreiche Hinweise und Studien vor. In diesem Fall beeinflusst überwiegend die Allgemeinerkrankung, also der DM, die endodontische Situation:
- Ein schlecht kontrollierter DM ist aufgrund inhibierter Makrophagenfunktion bei hohem Glukoselevel oft mit Parodontitis apicalis assoziiert [20].
- In einem systematischen Review mit 15 Studien (1.087 Patienten/-innen) wurde bei DM ein höheres Risiko von Parodontitis apicalis an wurzelkanalgefüllten Zähnen festgestellt, Diabetiker/-innen hatten ein dreimal höheres Risiko, eine Parodontitis apicalis zu entwickeln [6].
- Parodontale und endodontische Infektionen verlaufen bei Diabetikern/-innen häufig schwer (24% der Fälle), deutlich seltener nur moderat (2,3%) [21]. Diabetiker/-innen des Typs I zeigen deutlich häufiger periapikale Parodontitiden, vor allem bei längerer Dauer der Erkrankung [22].
- Im Pulpagewebe von Diabetikern/-innen finden sich Angiopathien und Kalzifikationen der Gefäße [23].
- Die Häufigkeit eines Flare-ups (Phoenix-Abszess) und postendodontischer Schmerzen gilt bei Diabetikern/-innen als erhöht [24,25].
- Es finden sich signifikant mehr Zähne mit symptomatischer irreversibler Pulpitis und Dentikeln, bei vitalerhaltenden Maßnahmen (direkte Überkappung, Vitalamputation) kommt es nicht zur Ausbildung eines Dentin-Bridging [26].
- Bei Diabetikern/-innen kommt es dreimal häufiger zu apikalen Abszessen als in der Kontrollgruppe [27].
- Eine Reihe von Studien berichten über eine deutlich reduzierte endodontische Erfolgsquote bei Diabetikern/-innen, es liegen aber auch abweichende Ergebnisse vor [25,28–31].
- In einer klinischen Studie mit 75 Patienten/-innen verzögerte sich bei Diabetes mellitus Typ II die Heilung einer Parodontitis apicalis, eine Parodontitis apicalis erhöhte die Entzündungsgesamtlast der Betroffenen, eine Wurzelkanalbehandlung führte zur Verbesserung des glykämischen Status bei DM [32].
- Eine Metaanalyse mit insgesamt 54.936 wurzelkanalbehandelten Zähnen, davon 50.301 bei Nichtdiabetikern/-innen und 4.635 bei Diabetikern/-innen, belegt, dass Diabetes mellitus einen signifikanten Risikofaktor für einen Zahnverlust nach einer Wurzelkanalbehandlung (Odds Ratio 2,44) darstellt [33].


Entzündliche Darmerkrankungen
In der Zahnmedizin und auch der Endodontie wenig beachtet, liegen einige Anhaltspunkte für Assoziationen zwischen Darmerkrankungen und endodontischen Problemen vor:
- Immunologische Veränderungen bei Personen mit entzündlichen gastrointestinalen Erkrankungen (z.B. Colitis ulcerosa, Morbus Crohn, Lebererkrankungen) beeinflussen die Produktion von Speichelzytokinen und Antikörpern. Vor allem während aktiver Phasen der Erkrankungen werden proinflammatorische Moleküle sezerniert, die eine Prädisposition zur Entwicklung periapikaler Entzündungen darstellen [35].
- Personen mit entzündlichen autoimmunen Darmerkrankungen (Colitis ulcerosa, Morbus Crohn) weisen eine höhere Prävalenz der apikalen Parodontitis auf als nicht betroffene Personen. 35,2% der Erkrankten wiesen zwei oder mehr periapikale Entzündungen auf, aber nur 16,7% der Gesunden (Odds Ratio 5,7) [36].
- Entzündliche Darmerkrankungen sind mit einer erhöhten Prävalenz von Wurzelkanalfüllungen und einer erhöhten Prävalenz an wurzelkanalgefüllten Zähnen mit Parodontitis apicalis assoziiert [37].
- Ein systematisches Review mit Metaanalyse unter Einschluss von sechs Studien zeigte, dass entzündliche Darmerkrankungen mit einem erhöhten Risiko einer apikalen Parodontitis und einer erhöhten Zahl betroffener Zähne einhergehen (OR 1,71) [38].
- Die Prävalenz einer apikalen Parodontitis betrug in der Gruppe von Personen mit entzündlichen Darmerkrankungen 64%, in der gesunden Kontrollgruppe 59%. Der Unterschied war bei Frauen signifikant. Frauen, die mit Immunmodulatoren behandelt wurden, wiesen eine höhere Prävalenz auf. Erkrankte zeigten ausgedehntere apikale Läsionen als Gesunde [39].
Lebererkrankungen
Daten zu Erkrankungen von Leber und Pankreas liegen nicht oder nur fragmentarisch vor [35], die Assoziationen sind in diesem Fall bidirektional:
- Das Vorliegen apikaler Parodontitiden erhöht das Risiko einer Mortalität bei Leberzirrhose (Hazard Ratio 1,79), zurückzuführen auf erhöhte Levels von C-reaktivem Protein [40].
- Eine Parodontitis apicalis geht mit erhöhten Serumkonzentrationen der Enzyme Alanin-Aminotransferase und Aspartat-Aminotransferase einher, die beide in die Pathologie der nicht alkoholbedingten Fettleber involviert sind, die wiederum zu Leberzirrhose oder maligner Entartung führen kann. Die Zahl der apikalen Läsionen war mit der Serumkonzentration der beiden Biomarker assoziiert [41].
- Im Mäusemodell wurde ein Einfluss periapikaler Entzündungen auf die Entwicklung von Leberfibrosen bei nicht alkoholbedingter Fettleber nachgewiesen [42].
Rheumatische Erkrankungen
Rheumatoide Arthritis – die globale Prävalenz wird mit 1% angegeben – bezeichnet eine Autoimmunerkrankung der Gelenke, die über Immunmodulation behandelt wird. Wie bei der apikalen Parodontitis spielen Zytokine eine wichtige Rolle in der Pathogenese. Seit langem wird daher über mögliche Assoziationen zwischen beiden Krankheitsbildern geforscht. Ein kausaler Zusammenhang wurde nicht nachgewiesen, beide Erkrankungen können sich aber gegenseitig negativ beeinflussen. Ob die Behandlung der Arthritis mit bestimmten Medikamenten auch die apikale Parodontitis positiv beeinflussen kann oder umgekehrt eine Wurzelkanalbehandlung den Verlauf der Arthritis erleichtern kann, ist bislang nicht ausreichend untersucht:
- In einem Vergleich von je 131 Personen mit und ohne rheumatoide Arthritis fand sich in der Gruppe der Erkrankten eine höhere Prävalenz an Zähnen mit apikaler Parodontitis (4% zu 3,5 %, nicht signifikant) und an Zähnen mit Wurzelkanalbehandlung (6,2% zu 5,6%, nicht signifikant). Die gesunden Personen wiesen signifikant mehr Zähne auf als die erkrankten [43].
- In einer Querschnittsstudie mit je 48 Personen mit und ohne rheumatoide Arthritis (1026 bzw. 1025 Zähne) betrug die Prävalenz der Zähne mit apikaler Parodontitis 4,3% bzw. 2%, der Unterschied war signifikant [44].
- Das Auftreten periapikaler Abszesse lag bei Vorliegen einer rheumatoiden Arthritis mit 1,5% signifikant höher als bei gesunden Personen (0,5%). Die Odds Ratio betrug 2,6 [45].
- Bei Personen mit rheumatoider Arthritis fanden sich signifikant mehr radiopaque Läsionen in der Periapikalregion als bei Gesunden der Kontrollgruppe (6,1% zu 2%) [46].
- Mehrfach wurde gezeigt, dass Porphyromonas gingivalis die Invasion von Th17-Zellen in die Gelenkkapseln induziert und zu einem schwereren Krankheitsverlauf der Arthritis führt [47].
- In apikalen Läsionen von Rheumapatienten/-innen wurden Plasmazellen nachgewiesen, die Rheumafaktoren (IgG) sezernieren. Die zur Behandlung der Arthritis verordneten Medikamente wirken immunsuppressiv, was wiederum die Prädisposition für die Entwicklung apikaler Läsionen erhöht [48].
- Eine Reihe proinflammatorischer Zytokine wird sowohl bei rheumatischer Arthritis als auch bei apikalen Läsionen gefunden, darunter IL-1, IL-6, IL-12, IL-17, Tumor-Nekrose-Faktor alpha, RANK und RANKL. Diese Literaturübersicht fand signifikante Assoziationen zwischen beiden Erkrankungen [49].
- Personen mit rheumatoider Arthritis, die mit Immunmodulatoren behandelt werden, zeigten eine höhere Prävalenz apikaler Läsionen [50].
- Rheumatische Arthritis war signifikant assoziiert mit einem erhöhten Risiko des Auftretens apikaler Läsionen (OR = 1,1284). Es wurden 84 Gene identifiziert, die in beide Erkrankungen involviert waren [51].

Autoimmunerkrankungen
Unter Autoimmunerkrankungen wird eine Vielzahl unterschiedlicher chronischer systemischer Entzündungen und Dysregulationen des Immunsystems zusammengefasst, die die Empfindlichkeit gegenüber Infektionen und die Gewebeheilung negativ beeinflussen. Hierzu zählen u.a. rheumatoide Arthritis, Lupus erythematodes und entzündliche Darmerkrankungen. Insgesamt sind ca. 400 Autoimmunerkrankungen bekannt, die jedes Organ betreffen können. Für einige dieser Erkrankungen sind Assoziationen zur oralen Gesundheit nachgewiesen (s. auch Faktenchecks „Rheumatoide Arthritis“ und „Darmerkrankungen“). Eine Dysfunktion oder Modulation des Immunsystems kann den Verlauf periapikaler Entzündungen beeinflussen. Zusätzlich zur systemischen Entzündung müssen in diesen Fällen die Dysfunktion des Immunsystems und die Wirkungen der Pharmakotherapie (z.B. mit Kortikosteroiden) berücksichtigt werden [52]:
- Bei vielen Autoimmunerkrankungen finden sich signifikant erhöhte Plasmakonzentrationen proinflammatorischer Zytokine wie Tumor-Nekrose-Faktor alpha (TNF-α) und Interleukin 1 und 6 (IL-1, IL-6). Diese Zytokine spielen auch bei der Gewebezerstörung im periapikalen Gewebe, der Parodontitis apicalis, eine entscheidende Rolle und fördern die Knochenresorption [56].
- Personen mit rheumatischer Arthritis und chronisch-entzündlichen Darmerkrankungen zeigen eine erhöhte Prävalenz periapikaler Entzündungen. Da sie aber ebenfalls deutlich höhere DMFT-Werte aufweisen, ist nicht geklärt, ob dies auf Defizite des Immunsystems oder die Auswirkungen der Karies zurückzuführen ist [39,44,52].
- In einer klinischen Untersuchung zur Prävalenz periapikaler Entzündungen bei Personen mit Autoimmunerkrankungen (rheumatoide Arthritis, chronisch-entzündliche Darmerkrankungen, Psoriasis) lag diese mit 89,9% signifikant höher als in der gesunden Vergleichsgruppe mit 74,2%, mit dem höchsten Risiko für Personen mit rheumatischer Arthritis und dem niedrigsten für Darmerkrankungen. Die Odds Ratio betrug 3,75. Bei „biologischer Medikation“ mit Disease-modifying antirheumatic drugs (bDMARDs) war das Risiko nochmals erhöht [53].
- In einer vergleichenden Studie an einer Personengruppe mit autoimmunen Erkrankungen der Leber und immunsuppressiver und evtl. auch immunmodulierender Therapie (n = 46) und 50 Gesunden als Vergleichsgruppe wiesen die medikamentös behandelten Erkrankten eine signifikant niedrigere Prävalenz apikaler Parodontitiden auf. Die angewendeten Medikationen können möglicherweise den Verlauf apikaler Erkrankungen positiv beeinflussen [54].
- Personen mit Autoimmunerkrankungen (rheumatoide Arthritis, chronisch-entzündliche Darmerkrankungen, Psoriasis) (n = 46) zeigten eine höhere Prävalenz periapikaler Aufhellungen als Gesunde (n = 50) [50].
- Der Vergleich der Röntgenaufnahmen von 131 Personen mit rheumatoider Arthritis und 131 Gesunden ergab, dass die Relation der Prävalenz von Zähnen mit apikaler Parodontitis 4% zu 3% betrug (nicht signifikant). Erkrankte Personen hatten aber signifikant weniger Zähne [43].
- Eine Metaanalyse von fünf Studien zu chronisch-entzündlichen Darmerkrankungen bestätigte, dass bei Erkrankten eine mit einer OR von 1,57 deutlich erhöhte Prävalenz periapikaler Entzündungen vorliegt [55].
- Die antiinflammatorische und immunsuppressive Behandlung autoimmuner Erkrankungen mit Kortikosteroiden beeinflusst auch die apikale Parodontitis negativ, da sie antimikrobielle Abwehrmechanismen im Periapex unterdrückt. Die Wirkung sogenannter „biological Disease-modifying antirheumatic drugs“ (bDMARDs) auf periapikale Entzündungen wird unterschiedlich bewertet. In einigen Studien wurde eine niedrigere Prävalenz apikaler Parodontitiden registriert, in anderen keine entsprechende Wirkung [52].
- Bei Personen mit Autoimmunerkrankungen sollten nach endodontischen Behandlungen längere Recallperioden zur Erfolgsbewertung eingeplant werden, um temporäre medikamenteninduzierte Effekte (Immunsuppression oder Immunmodulation) nicht falsch einzuschätzen [52].

Im zweiten Teil dieser Artikelserie werden weitere Assoziationen beschrieben und diskutiert.
Teil 2
 Ahmet Aglamaz/AdobeStock
Ahmet Aglamaz/AdobeStockDer demografische Wandel führt auch in Zahnarztpraxen zu einem veränderten Patientenkollektiv. Durch den zunehmenden Anteil älterer Menschen steigt die Wahrscheinlichkeit, endodontische Behandlungen an Patienten/-innen mit reduzierter Allgemeingesundheit durchführen zu müssen. Teil I dieser Artikelfolge befasste sich mit Zusammenhängen zwischen Endodontie und Herz-Kreislauf-Erkrankungen, Diabetes, Autoimmunerkrankungen, Darm- und Lebererkrankungen sowie Erkrankungen des rheumatischen Formenkreises [3]. Im vorlegenden zweiten Teil werden Zusammenhänge mit Erkrankungen des hämatopoetischen Systems, Allergien, Osteoporose und Virenerkrankungen thematisiert. Die Zusammenstellung beruht auf den von den Autoren erstellten und über Social media veröffentlichten „Faktenchecks“ der DGET.
Bedingt durch das zunehmende Durchschnittsalter der Bevölkerung nimmt auch die Zahl der Patienten/-innen mit Einschränkungen der Allgemeingesundheit, Gelenkersatz, Organersatz, chronischen Erkrankungen und Dauermedikationen zu. Viele häufig vorliegende Erkrankungen und Einschränkungen müssen ebenso wie Medikationen aufgrund möglicher negativer Wechselwirkungen auch bei endodontischen Behandlungen berücksichtigt werden. Zusammenhänge zwischen Allgemeingesundheit und Endodontie werden auch unter dem Begriff „Endodontic Medicine“ [1,2] diskutiert. Die Deutsche Gesellschaft für Endodontologie und zahnärztliche Traumatologie (DGET) hat dieses Thema in den Mittelpunkt ihrer derzeitigen Aktivitäten gestellt.
Endodontie und Erkrankungen des hämatopoetischen Systems
Zu den wichtigsten Erkrankungen des hämatopoetischen Systems und bei einer Wurzelkanalbehandlung zu berücksichtigenden Besonderheiten zählen:
- Leukämie: Dies ist eine der häufigsten Krebserkrankungen und beruht auf einer abnormen Proliferation unreifer Blutzellen im Knochen, die dann in das Gefäßsystem übertreten.
- Lymphome sind von Lymphozyten ausgehende Tumoren (Hodgkin oder Non-Hodgkin-Lymphome).
- Gerinnungsstörungen/Hämophilie: Unterschieden werden die aus einer Störung des Faktors VIII resultierende Hämophilie A, die Hämophilie B (Reduktion des Faktors IX) und das Von-Willebrand-Jürgens-Syndrom (angeborene hämorrhagische Diathese mit Faktor-VIII-Defizit und verlängerter Blutungszeit).
- Stammzelltransplantationen, die bei malignen hämatologischen Erkrankungen zum Ersatz erkrankter durch gesunde allogene oder autologe Stammzellen zur Stärkung des Immunsystems vorgenommen werden und mit Chemo- oder Strahlentherapie verbunden sind.
- Sichelzellanämie (SCA) als eine der häufigsten genetisch bedingten Erkrankungen. Eine genetische Mutation resultiert in der Bildung atypischen Hämoglobulins. Am Ende einer Reaktionskaskade steht die Bildung atypischer Erythrozyten mit sichelzellförmiger Konfiguration, die dadurch Kapillaren blockieren können. Ischämie, Schmerzen, Gewebezerstörung, avaskuläre Knochennekrosen, Osteoporose und Herzinfarkt können weitere Folgen sein.
- SCA-Patienten/-innen gelten als sehr anfällig gegenüber Infektionen.
Zahlreiche Fallbeschreibungen berichten über orale Komplikationen, v.a. UK-Osteomyelitis, Anästhesien des N. mandibularis und asymptomatische Pulpanekrosen. Patienten/-innen mit SCA benötigen in der Regel Bluttransfusionen.
Leukämie und Lymphome
Bei ca. 30 bis 50% der vom hämatopoetischen oder lymphatischen System ausgehenden malignen Erkrankungen ist das stomatognathe System, v.a. der Kieferknochen, involviert. Als typische radiologische Erscheinungsformen solcher lymphom- oder leukämieassoziierter osteolytischer Läsionen in der Apikalregion werden eine homogene Röntgendichte, unregelmäßige Formen und diffuse Ränder beschrieben. Insbesondere Letzteres wird zur Differenzierung von endodontisch induzierten Läsionen empfohlen [3]. Die knöchernen Läsionen werden häufig zunächst als endodontisch induzierte periapikale Läsionen fehldiagnostiziert und die benachbarten Zähne wurzelkanalbehandelt [4,5].
Eine systematische Literaturübersicht mit 32 ausgewerteten Studien ergab eine Prävalenz der Lokalisation solcher lymphom- bzw. leukämieinduzierten Knochendefekte in der Periapikalregion von Zähnen bei 97% der diagnostizierten B-Zell-Lymphome, weit überwiegend im Unterkiefer. In fast 95% der Fälle war der Lymphomdiagnose eine (in vermutlich 50% der Fälle nicht indizierte) Wurzelkanalbehandlung vorausgegangen. Die Lymphom-/Leu-kämiediagnose verzögerte sich durch die Fehldiagnose im Mittel um fast fünf Monate [5]. Bei Zähnen mit radiologisch erkennbaren benachbarten knöchernen Läsionen sollte daher bei positivem Ergebnis eines Sensibilitätstests trotz geringer Prävalenz eine lymphomassoziierte Läsion in die Differenzialdiagnose einbezogen werden [6].
Hämophilie
In einer Querschnittsstudie mit 58 Personen mit angeborenen Gerinnungsstörungen (Hämophilie A und B, Von-Willebrand-Syndrom) und ebenso vielen gesunden Kontrollen zeigte sich, dass 67,2% der Erkrankten an mindestens einem Zahn eine apikale Parodontitis aufwiesen, bei den Kontrollpersonen nur 48,3%. Der Unterschied war signifikant, die Odds Ratio (OR) betrug 2,2. 34,5% der Erkrankten und 65,5% der Gesunden wiesen mindestens einen wurzelkanalbehandelten Zahn auf, der Unterschied war ebenfalls signifikant. Bei den Erkrankten mit Wurzelkanalfüllung war bei 70% eine apikale Läsion an den behandelten Zähnen zu erkennen, bei den Kontrollen nur bei 36,8% [7].
Endodontische Behandlungen gelten als Low-Risk-Maßnahmen. Zur Anästhesie sind bei Patienten/-innen mit Hämophilie Anästhetika mit Vasokonstriktor zu bevorzugen. Anstelle einer Leitungsanästhesie wird die intraligamentäre Injektion empfohlen. Die Einnahme nichtsteroidaler antiinflammatorischer Analgetika (NSAIDs) ist kontraindiziert. Zur postoperativen Schmerzkontrolle sind langwirkende Anästhetika wie Bupivacain-Hydrochlorid gut geeignet [8]. Pulpektomien und Pulpotomien sind gegenüber Extraktionen zu bevorzugen. Patency-Techniken und Überinstrumentationen sollen vermieden werden.
Eine nichtchirurgische endodontische Behandlung (Pulpotomie, Pulpektomie) kann ohne Faktorsubstitution durchgeführt werden, eine präendodontische Rücksprache mit dem/der Hämatologen/-in wird empfohlen [8]. Einige Vorsichtsmaßnahmen müssen bei der Behandlung beachtet werden:
- Vermeidung von Überinstrumentierung
- strikt aseptische Kautelen
- intraligamentäre Anästhesie statt Leitungsanästhesie
- nach Vitalexstirpation medikamentöse Einlage mit Ca(OH)2
- keine Änderung einer Antikoagulanzienmedikation durch Zahnarzt/Zahnärztin [9].
Intrakanaläre Blutungen (Restgewebe, Perforationen) können mithilfe von Natriumhypochloritspülungen und Kalziumhydroxideinlagen in der Regel einfach gestillt werden [8]. Als Folge einer endodontischen Behandlung können u.U. aufgrund interstitieller Blutungen leichte Begleiterscheinungen wie Ekchymosen und Hämatome auftreten, die aber zeitnah rückstandlos ausheilen [8].
Ein einheitliches Protokoll zum Umgang mit Patienten/-innen mit Gerinnungsstörungen (Hämophilie A oder B) liegt nicht vor. Empfohlen werden die Verwendung atraumatischer Nadeln für die Injektion und vorzugsweise die Infiltrations- oder intraligamentäre Anästhesie, als Anästhetika werden Articain und Lidocain genannt. Zur Blutstillung wird häufig Tranexamsäure verwendet [11,12]. In einer Nachkontrolle von 51 Wurzelkanalbehandlungen (64% Molaren) bei 28 Personen mit einer hämorrhagischen Diathese, 17 Vitalexstirpationen und 34 Behandlungen von Pulpanekrosen, wurden keine Blutungs- oder Entzündungskomplikationen registriert, sieben Zähne wurden einer Wurzelspitzenresektion unterzogen, kein/-e Patient/-in benötigte eine Faktorsubstitution oder INR-Wert-Anhebung. Die Recalluntersuchungen nach 9 bis 48 Monaten bei 24 Personen ergaben mit einer Ausnahme Symptomfreiheit und nur zwei Fälle mit verbreitertem Parodontalspalt [13].
Sichelzellanämie
Sichelzellerkrankungen umfassen eine Reihe genetisch bedingter Krankheitsbilder. Durch den Gendefekt wird eine Aminosäure in der ß-Hämoglobin-Kette ersetzt, was die Löslichkeit des Hämoglobins herabsetzt und in Phasen niedriger Oxidation zu einer sichelzellförmigen Deformation der roten Blutkörperchen führt. Wenn der Abbau dieser anormalen Zellen sich schneller vollzieht als die Neubildung, kann es leicht zu Anämien kommen, die Infektanfälligkeit ist erhöht. Da die deformierten Zellen die Blutversorgung zu bestimmten Regionen behindern können, kommt es zu Anoxie, Infarkten, Nekrosen und Schmerzen.
Zu den berichteten oralen Symptomen zählen die Anästhesie des N. mandibularis inferior, Unterkieferosteomyelitis und asymptomatischer Vitalitätsverlust auch in intakten, karies- und füllungsfreien Zähnen. Röntgenologisch imponieren u.U. multilokuläre röntgenologische Läsionen an den Wurzelspitzen auch pulpavitaler Zähne [14]. Auch in klinisch intakten, kariesfreien Zähnen können als Folge eines Gefäßverschlusses asymptomatische Pulpanekrosen auftreten [15–17]. Demirbas et al. verglichen die radiologischen Symptome von 36 Patienten/-innen mit Sichelzellanämie (SCA) und 36 gesunden Kontrollen. 6% der restaurationsfreien Zähne (n = 51) ohne früheres Trauma erwiesen sich in der SCA-Gruppe als nicht pulpavital.
In 30 Fällen der SCA-Patienten/-innen (83%) wurden orofaziale oder dentale Schmerzen ohne ersichtliche Ursache diagnostiziert. Bei 24 SCA-Personen (67%) zeigte sich röntgenologisch eine kompromittierte Knochenqualität, bei 22% (n = 8) eine ausgedünnte Kortikalis, die Unterschiede zur gesunden Kontrollgruppe hinsichtlich Pulpasensibilität und röntgenologischen Befunden waren signifikant. Pulpanekrosen und röntgenologische Veränderungen an klinisch intakten Zähnen können bei SCA-Patienten/-innen auch ohne klinische Symptome und erkennbare Ursachen auftreten und gelten als primäre Symptome einer SCA [17]. Bei Personen mit Sichelzellanämie fanden sich achtmal so viele karies- und füllungsfreie Zähne mit Pulpanekrose.
Als Ursache gilt die aufgrund reduzierter Sauerstoffspannung deutlich von etwa 120 auf 15 bis 25 Tage verringerte Lebenszeit der Erythrozyten, die nach ihrer Zerstörung durch Zellen des retikoendothelialen Systems (RES) akkumulieren und die Blutgefäße blockieren können. Zusätzlich zeigen Sichelzellen mit ihrer modifizierten Form eine stärkere Adhärenz an das Gefäßendothel, was den ersten Effekt verstärken kann [18].
Patienten/-innen mit Stammzelltransplantation
Eine hämatopoetische Stammzelltransplantation (hematopoetic stem cell transplantation, HSCT) ist heute eine häufig durchgeführte zelluläre Immuntherapie bei Personen mit Krebserkrankungen (u.a. Brustkrebs) und bestimmten Erkrankungen des blutbildenden Systems (multiples Myelom, aplastische Anämie, Leukämie, Lymphom). Die Transplantation kann autolog oder allogen erfolgen, z.B. durch eine Knochenmarkspende. Weltweit werden jährlich etwa 50.000 dieser Behandlungen durchgeführt.
In der Vorbereitungsphase wird über Chemo- oder Radiotherapie das lymphohämatopoetische System zerstört, um die Infusion neuer blutbildender Zellen zu ermöglichen. In diesem Zeitraum sind die Betroffenen wegen immunsuppressiver Medikation extrem anfällig gegenüber lebensbedrohenden Infektionen. 80% aller Betroffenen entwickeln nach der Stammzelltransplantation mindestens einmal eine Infektion, 40% der Todesfalle nach HSCT sind auf Infektionen oder Abstoßungsreaktionen zurückzuführen [19,20]. Die Prävalenz apikaler Parodontitiden in Personengruppen mit HSCT wird mit 11 bis 46% angegeben.
In einer retrospektiven Kohortenstudie mit 100 Patienten/-innen mit autologer Stammzelltherapie wurde bei 41% ein endodontischer Behandlungsbedarf diagnostiziert, von denen wiederum 75,6% eine Parodontitis apicalis aufwiesen. Bei 23 Personen wurden endodontische Primärbehandlungen oder Revisionsbehandlungen durchgeführt. In keinem Fall kam es zu Komplikationen (Bakteriämie, Fungämie, Schmerzen, Schwellung) [19]. In einer weiteren Untersuchung von 272 Personen vor einer HSCT wiesen ca. 25% apikale Läsionen auf, bei 17,4% musste vor der HSCT mindestens eine akute orale Entzündung behandelt werden [21].188 Personen vor und nach Stammzelltransplantation wurden in Brasilien auf klinische und epidemiologische Parameter untersucht. In der Vor-Transplantationsgruppe benötigten 24,3%, in der Nach-Transplantationsgruppe 24,7% eine endodontische Behandlung, die meisten an mehr als einem Zahn [20].
In einer systematischen Übersicht mit acht ausgewerteten Studien wurde der Anteil der Personen mit endodontischem Behandlungsbedarf mit 2,1 bis 46,3% angegeben [22]. Es besteht keine Notwendigkeit, Zähne mit chronischer apikaler Parodontitis zu entfernen, eine Behandlung in Phasen der Remission ist möglich. Akute Infektionen sollen vor oder zu Beginn der onkologischen Therapie behandelt werden. Bei geplanten Extraktionen sind die Risiken von schwierig zu stillenden Blutungen, Wundheilungsstörungen aufgrund der Thrombozytopenie und Infektionen der Extraktionswunde zu berücksichtigen. Für invasive zahnärztliche Behandlungen wird eine einstündige präoperativ durchgeführte Antibiose mit Amoxicillin 2 g oder bei Allergie mit Clindamycin 600 mg empfohlen [23,24]. Die Nichtbehandlung asymptomatischer Läsionen an wurzelkanalbehandelten Zähnen erhöht die Inzidenz infektiöser Komplikationen nach Knochenmarktransplantationen nicht [25].

Viruserkrankungen
Viren treten in unterschiedlichen Formen auf, die bekanntesten sind COVID-19, HIV und Hepatitisviren. Alle sind von Relevanz für die Endodontie. Neben dem immensen Risiko der Infektionsübertragung von Patienten/-innen auf das Zahnärzte/-innen-Team und umgekehrt existieren auch Wechselwirkungen mit endodontischen Fragestellungen. Diese Zusammenhänge sind bislang aber noch nicht durchgängig gut untersucht [26,27].
In einer Übersicht wurden Viren in apikalen Läsionen in 18 von 21 Studien nachgewiesen. Epstein-Barr-Viren (Humanes Herpesvirus 4; HHV-4) wurden in 17 Studien, in 213 (41%) von 520 untersuchten Proben und das Zytomegalie-Virus (HHV-5) in 18 Studien, in 187 (34%) von 553 Proben nachgewiesen. Andere Viren wurden mit folgender Häufigkeit detektiert: HHV-6 in 10 von 73 Proben mit endodontischen Erkrankungen, HHV-7 in 1 von 33, HHV-8 in 18 von 33, Humanes Papillomavirus (HPV) in 3 von 55, Varizella-Zoster-Virus (VZV) in 3 von 146 [28].
Eine histochemische und immunhistochemische Untersuchung an 60 Gewebeproben der koronalen Pulpa extrahierter impaktierter Zähne, davon je 30 von gesunden und von Hepatitis-C-infizierten Patienten/-innen, ergab statistisch signifikante Unterschiede bezüglich der Anzahl der Fibroblasten und Entzündungszellen, der Dichte der Arteriolen, Venolen und Lymphgefäße, der Dicke der Arteriolen, der Menge an Kollagen sowie der Ausschüttung von Fibronektin [29].
In den Speichelproben von 72 Patienten/-innen mit Herpes war das am häufigsten gefundene Virus mit 84% bei erfolgreicher Wurzelkanalbehandlung und 89% bei Misserfolgen das Humane Herpesvirus 8, gefolgt von HCVM mit 22% bei erfolgreichen bzw. 30% bei nicht erfolgreichen Behandlungen [30]. In den Proben der Patienten/-innen mit einer endodontischen Erkrankung fanden sich im Vergleich zu den Proben gesunder Patienten/-innen Ebstein-Barr-Virus-DNA signifikant häufiger als die DNA aller anderen untersuchten Viren. In den Proben mit irreversibler Pulpitis waren es 31,0%, in den Proben mit primärer apikaler Parodontitis 53,3%, und in Proben bei bereits wurzelkanalbehandelten Zähnen mit einer apikalen Parodontitis 47,8% [31].
In einer brasilianischen Studie wird über eine hohe Prävalenz periapikaler Läsionen (46%) unter HIV-positiven Patienten/-innen berichtet [31]. De Brito et al. [32] ermittelten einen endodontischen Behandlungsbedarf bei 14,5% der 166 untersuchten Infizierten, 79% der Personen mit apikalen Läsionen befanden sich in der hochaktiven antiretroviralen Therapie (HAART) [32,33].
Aerosole spielen für die Übertragung des Corona-19-Virus eine große Rolle [34]. Die Viren können sich lange in der Luft befinden und sich trotz direkter postoperativer Oberflächendesinfektion erst später auf diesen Oberflächen niederlassen, auf denen sie mehrere Tage überleben können; exakte Zeitangaben liegen hierzu nicht vor. Der Virus lässt sich durch Seife und Desinfektionsmittel schnell eliminieren [26,27]. Xu et al. wiesen eine hohe Expression des ACE2 auf intraoralen Geweben und vor allem in Speicheldrüsen und auf Epithelzellen der Zunge nach, was den Mund- und Rachenraum zu einem Hochrisikogebiet für eine Infektionsübertragung macht. Zahnärzte/-innen gelten als die Berufsgruppe mit dem höchsten Infektionsrisiko [35,36].
Hepatitisviren, Papillomviren und Herpesviren wurden bereits in Gewebeproben oder Pus aus endodontisch erkrankten Zähnen gefunden. Da sie auf vitale Gastzellen angewiesen sind, können Viren in nekrotischem Gewebe nicht überleben [26,27]. Es besteht eine Korrelation zwischen Epstein-Barr-Viren (HHV-4), Zytomegalieviren (HHV-5) und periapikalen Entzündungen: In 146 von 406 Proben wurde eine der beiden Virenarten nachgewiesen. Herpesviren HHV-1 und HHV-2 wurden erheblich seltener gefunden (16 von 283 bzw. 2 von 37, in 5 von 10 Studien wurden keine dieser Virentypen entdeckt), EBV können in Verbindung mit einer irreversiblen Pulpitis oder apikalen Parodontitis gebracht werden [28].
Eine retrospektive Studie untersuchte den Einfluss von HIV auf den Erfolg von Wurzelkanalbehandlungen an 33 HIV-infizierten und 33 HIV-negativen Patienten/-innen. Sowohl HIV-positive als auch HIV-negative Patienten/-innen zeigten ein Jahr nach der Behandlung signifikant bessere periapikale Befunde als vor der Behandlung. Zwischen beiden Patientengruppen wurden weder vor noch nach der Behandlung signifikante Unterschiede festgestellt. Die Chancen auf Therapieerfolg und Heilung einer periapikalen Läsion sind demzufolge allein aufgrund einer bekannten HIV-Infektion nicht verringert [37].
In einer vergleichenden 24-Monats-Kontrollstudie mit 46 HIV-positiven und 59 HIV-negativen Patienten/-innen unterschieden sich die Erfolgsquoten nicht signifikant, bei den HIV-Positiven benötigte die Heilung der periapikalen Läsionen aber mehr Zeit, präoperativ wurden in dieser Gruppe stärkere Schmerzen berichtet [38]. Die Komplikationsrate nach Wurzelkanalbehandlungen betrug 13,6%, was sich nicht von den in der Literatur angegebenen Komplikationsraten bei HIV-negativen Patienten/-innen unterscheidet. Eine prophylaktische Antibiotikagabe bei HIV-infizierten Patienten/-innen ist nach Meinung der Autoren nicht indiziert [38].

Jede/r Patient/-in der Zahnarztpraxis sollte als potenzielle Virusquelle angesehen werden. Eine sorgfältige Erhebung der Anamnese, aktive Immunisierung des zahnärztlichen Personals mit sämtlichen existenten Vakzinen, eine adäquate Händehygiene, Schutz vor Verletzungen, korrekte Desinfektions- und Sterilisationsverfahren sowie die Einhaltung der Infektionsschutzrichtlinien können das Ansteckungsrisiko durch Viren in einer Zahnarztpraxis minimieren.
Endodontie und Osteoporose
Osteoporose bezeichnet eine systemische skelettale Erkrankung, die durch eine Dysbalance der Knochenremodellierung gekennzeichnet ist. Ein Überwiegen der Osteoklastenaktivität gegenüber der Osteoblastentätigkeit resultiert in der Reduktion der Knochenmasse und Änderungen der Knochenmikrostruktur mit fragilerem, weniger kompaktem Knochen, der anfälliger für Frakturen und Infektionen ist. Osteoporose kann mit erhöhten Serumkonzentrationen proinflammatorischer Zytokine assoziiert sein, wodurch Resorptionen begünstigt und Heilungsprozesse im Knochen verlangsamt werden können. Weltweit sind über 200 Mio. Menschen betroffen, Personen über 65 Jahre und postmenopausale Frauen weisen eine erhöhte Prävalenz auf [40].
Zur Therapie malignominduzierter Knochenresorptionen und zur Behandlung der Osteoporose werden peroral oder intravenös applizierte Bisphosphonate eingesetzt, die die Knochenresorption – aber damit auch die Knochenregeneration – verhindern. Die Medikamente wirken auch antiangiogenetisch, es resultiert ein weitgehend avaskulärer Knochen. Eine Bisphosphonatmedikation geht mit in einer erhöhten Inzidenz schwer therapierbarer Knochennekrosen nach invasiven dentalen Eingriffen wie Extraktionen oder oralchirurgischen Behandlungen einher [41]. Die Komplikationsraten nehmen pro Jahr der Bisphosphonattherapie etwa um 9% zu [42].
Personen mit intravenöser Gabe haben nach dentoalveolär-chirurgischen Eingriffen ein 5- bis 21fach erhöhtes Risiko einer BRONJ (Bisphosphonate related osteonecrosis of the jaw) [43]. Die Inzidenz der BRONJ liegt bei 0,8 bis 12%, wovon 65 bis 70% der Fälle auf den Unterkiefer entfallen [26,27]. Die Halbwertszeit von Bisphosphonaten beträgt ca. zehn Jahre, die vom Knochen aufgenommene Menge hängt vor der Darreichungsform ab: bei oraler Gabe 20 bis 50%, bei intravenöser Gabe 70 bis 80%. Eine kurzfristige Absetzung der Medikation erbringt daher keine positiven Effekte und keine Senkung des BRONJ-Risikos. Das unerwartete und/oder wiederholte Auftreten einer BRONJ kann als Prädiktor einer Osteoporose bewertet werden [45-48].
Die Verfasser von zwei systematischen Literaturübersichten kamen nach Auswertung von jeweils drei in Frage kommenden Studien zu der Schlussfolgerung, dass Osteoporose mit einer um den Faktor 3,4 erhöhten Prävalenz periapikaler Parodontitiden assoziiert ist. Wurzelkanalbehandelte Zähne wiesen eine höhere Prävalenz periapikaler Entzündungen auf als nichtbehandelte Zähne. Zur Frage, ob eine Medikation mit Bisphosphonaten Einfluss auf die Prävalenz apikaler Läsionen hat, fanden die Autoren widersprüchliche Ergebnisse in der Literatur [40,49]. Die Auswertung der Akten von 1,6 Mio. Klinikpatienten/-innen ergab eine Prävalenz periapikaler Läsionen von 1,78% bei Vorliegen einer Osteoporose, in der Kontrollgruppe lag sie bei 0,52% (OR 3,6). Bei Personen mit Bisphosphonatmedikation betrug die Prävalenz apikaler Läsionen 1,25% der Betroffenen.
Die OR lag niedriger als bei nicht mit BP medizierten Personen (2,3 versus 3,5) [50]. In 119 Fällen von Bisphosphonatosteonekrosen lag als Komorbidität bei 10,9% (n = 13) eine Wurzelkanalbehandlung mit röntgenologisch erkennbarer Parodontitis apicalis und bei 13,4% (n = 16) ein apikaler Abszess vor [51]. In einer retrospektiven Untersuchung von Wurzelkanalbehandlungen an 43 Zähnen mit Par-odontitis apicalis bei Patienten/-innen mit oraler Bisphosphonattherapie betrug die Heilungsquote 73,5%, während 38 Kontrollzähne mit Parodontitis apicalis bei Patienten/-innen ohne Bisphosphonattherapie eine Quote von 81,6% aufwiesen; der Unterschied war jedoch nicht signifikant [52].
Es können zwei Risikoprofile unterschieden werden:
- Hochrisikopatienten/-innen (Inzidenz einer BRONJ: 2 bis 12%): intravenöse Gabe oder Bisphosphonatmedikation länger als drei Jahre, multiples Myelom, Brustkrebs, Knochentumoren
- Niedrig-Risiko-Patienten/-innen (Inzidenz einer BRONJ: 0,001–0,01%): orale Gabe und Medikation kürzer als drei Jahre, Osteoporose, Morbus Paget [9].
![Empfehlungen
Vor einer Bisphosphonattherapie sollte eine sorgfältige orale
Sanierung durchgeführt werden. Eine orthograde Wurzelkanalbehandlung
ist bei Betroffenen nicht mit einem erhöhten BRONJ-Risiko
verbunden. Auch nicht mehr restaurierbare Zähne sollen zur
Vermeidung BRONJ-assoziierter Extraktionen durch endodontische
Behandlungen möglichst erhalten werden. Ist ein Zahn koronal
nicht restaurierbar, kann eine alleinige Abdeckung der endodontisch
behandelten Wurzel mit Komposit erwogen werden. Bei der
endodontischen Behandlung sollten marginale (Kofferdamklammer)
sowie apikale (Überinstrumentierung, Überfüllung) Reizungen
von Schleimhaut und Knochen vermieden werden [53].](https://dentalwelt.spitta.de/wp-content/uploads/2025/06/Kasten-3-jpg.webp)
Bei der Wurzelkanalbehandlung bei Personen mit Osteoporose sind die folgenden Therapiemodifikationen zu berücksichtigen (Tab. 1).
| Vor Bisphosphonat-medikation | Während Bisphosphonat-medikation | |
| Anästhesie | keine Besonderheit | adrenalinfreie Anästhetika |
| Wurzelkanalbehandlung | indiziert | indiziert; bei Hochrisikopatienten/-innen unter antibiotischer Abschirmung |
| Endochirurgie | indiziert | kontraindiziert |
| Extraktion | indiziert | wenn möglich vermeiden; ansonsten immer unter antibiotischer Abschirmung |
| Antibiotikaprophylaxe | nein | ja; ggf. vor WKB und immer vor allen chirurgischen Maßnahmen |
| Therapiemodifikationen | keine | Überinstumentierung und Überfüllung tunlichst vermeiden; keine Patency-Technik |
| Risikofaktoren | keine | bisphosphonatassoziierte Kiefernekrose |
| Prognose einer Wurzelkanalbehandlung | nicht reduziert | nicht reduziert |
Allergien
In der Endodontie verwendete Substanzen können Verursacher allergischer Reaktionen sein, eine sorgfältige Anamnese, bei Bedarf mit dezidierter Nachfrage (Latex, Handschuhe, Kondome, Haushaltsreiniger, frühere Zwischenfälle bei zahnärztlichen Behandlungen, frühere allergische Reaktionen) ist zu empfehlen (Tab. 2). Ein Einfluss allergischer Dispositionen auf endodontische Erkrankungen oder Behandlungen ist – mit einer Ausnahme – nicht bekannt, allerdings auch nicht untersucht.
| Allergie gegen | |
| Lokalanästhetika | Konservierungsstoffe Amide (z.B. Lidocain, Articain) |
| Handschuhe | Latex |
| Kofferdam | Latex |
| Spülungen und medikamentöse Einlagen | Eugenol Natriumhypochlorit Chlorhexidin alle Jodverbindungen (Jod-Jod-Kalium; Jodoform) (Para-)Formaldehyd (Devitalisierungsmittel) |
| Wurzelkanal-füllmaterialien | Zinkoxideugenole Epoxidharze Silber Formaldehyd |
| Medikamente | Penicilline Analgetika (z.B. Acetylsalicylsäure) |
In einer Übersichtsarbeit werden folgende Stoffgruppen als mögliche Auslöser allergischer Reaktionen benannt:
- Lokalanästhetika
- latexhaltige Behandlungshandschuhe
- latexhaltiger Kofferdam
- Spüllösungen: Eugenol, Chlorhexidin, Hypochlorit. Jod-Jod-Kali
- Fixative, Devitalisationsmittel: Formaldehyd (z.B. N2, Toxavit, „Russian Red”, Caustinerf)
- Wurzelkanalfüllmaterialien: Guttapercha, Silber, Epoxidsealer
- temporäre Füllmaterialien auf Polyethylenglycol-Basis
- Kortikosteroide: Endomethasone
- Antibiotika
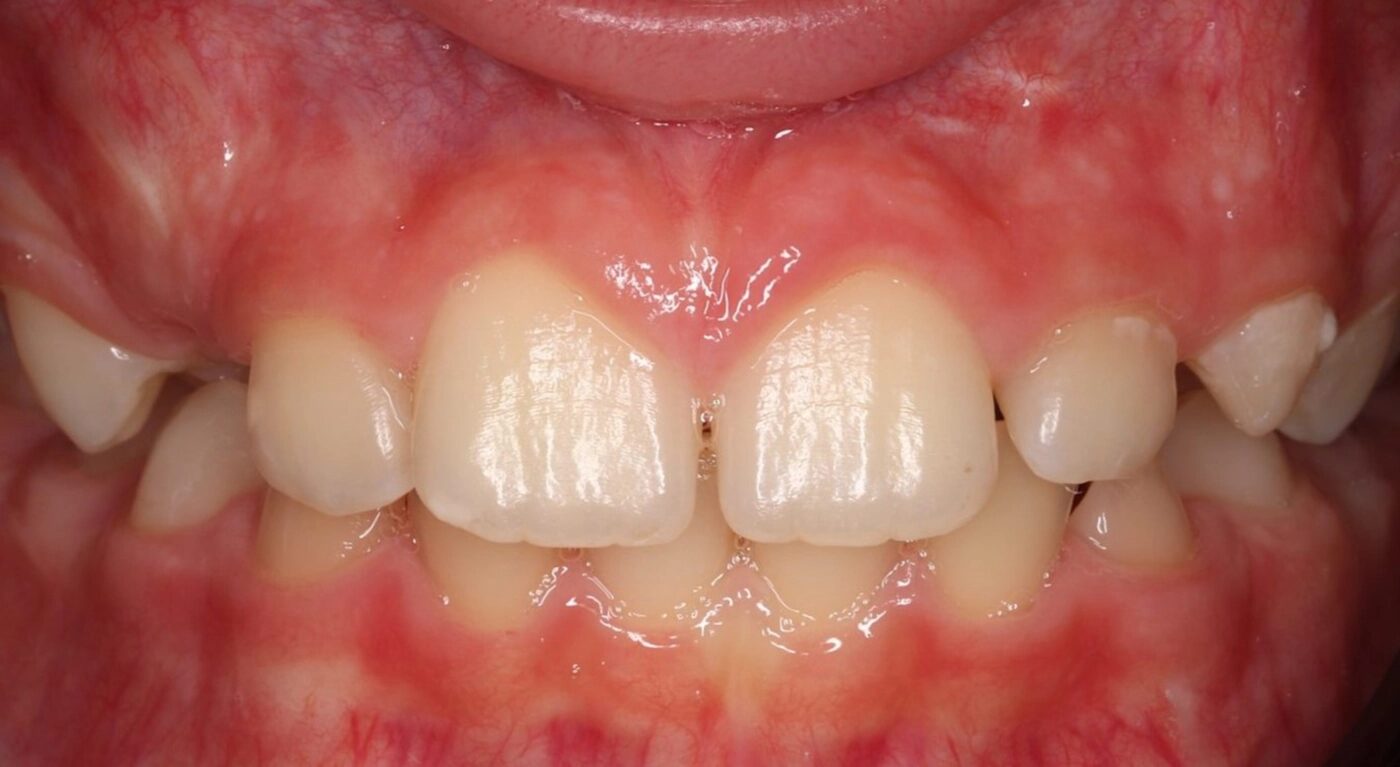
Für die meisten der genannten Substanzen liegen nur einzelne Fallberichte vor, von einer weit höheren Dunkelziffer muss ausgegangen werden. Bis auf zwei Fälle mit schwerer anaphylaktischer Reaktion handelt es sich bei den geschilderten Fällen überwiegend um leichte Reaktionen ohne irreversible Schäden [54] (Abb. 1).
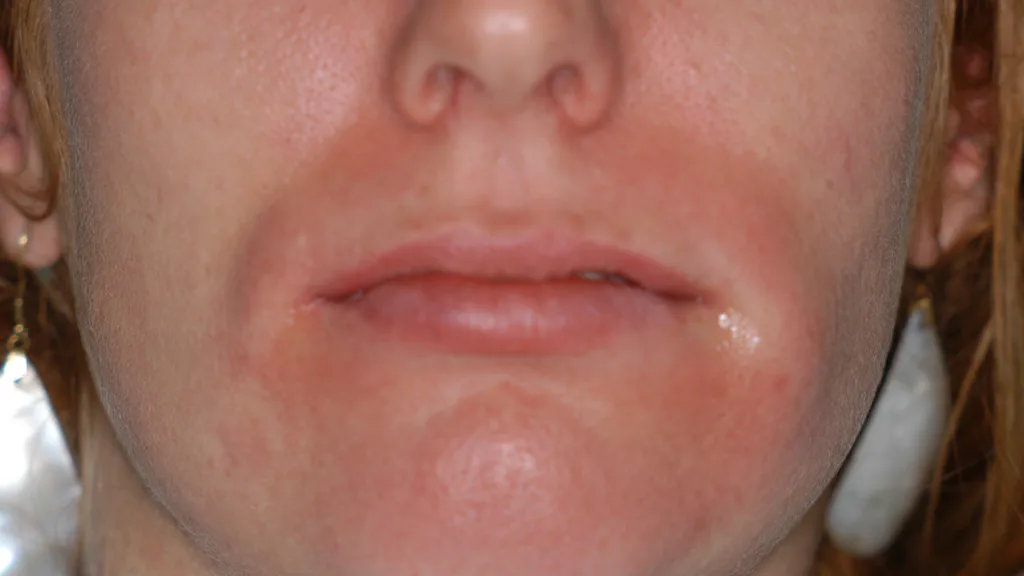 Hülsmann / Schäfer
Hülsmann / SchäferLatex
Für allergische Reaktionen auf Latex (Handschuhe, Kofferdam), meist in Form von Hauthypersensitivitäten, sind in der Gummisubstanz (Naturkautschuk, Balata gutta) enthaltene Proteine verantwortlich (Abb. 1). Zur Behandlung von Personen mit bekannter Latexallergie müssen latexfreie Produkte verwendet werden [54].
Guttapercha
Es liegen nur wenige Fallberichte über vermutete, meist aber nicht eindeutig nachgewiesene allergische Reaktionen auf Guttapercha vor. Bislang gibt es keine Hinweise auf Kreuzreaktionen zwischen Latex und Guttapercha [54].
Natriumhypochlorit (NaOCl)
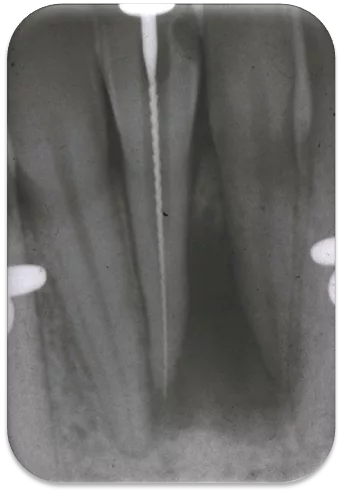
Es sind einige Fälle von Unverträglichkeitsreaktionen auf NaOCl bekannt. Da sowohl Natrium als auch Chlor essenzielle Spurenelemente sind, handelt es sich um Hypersensitivitäten, nicht um schwere allergische Reaktionen. Zu berücksichtigen ist, dass es bei apikaler Extrusion zugleich zu Schädigungen der betroffenen Gewebestrukturen (Rupturen von Blutgefäßen, Gewebenekrosen) mit unterschiedlicher Ausprägung der resultierenden Symptome und Schäden kommt (Abb. 2).
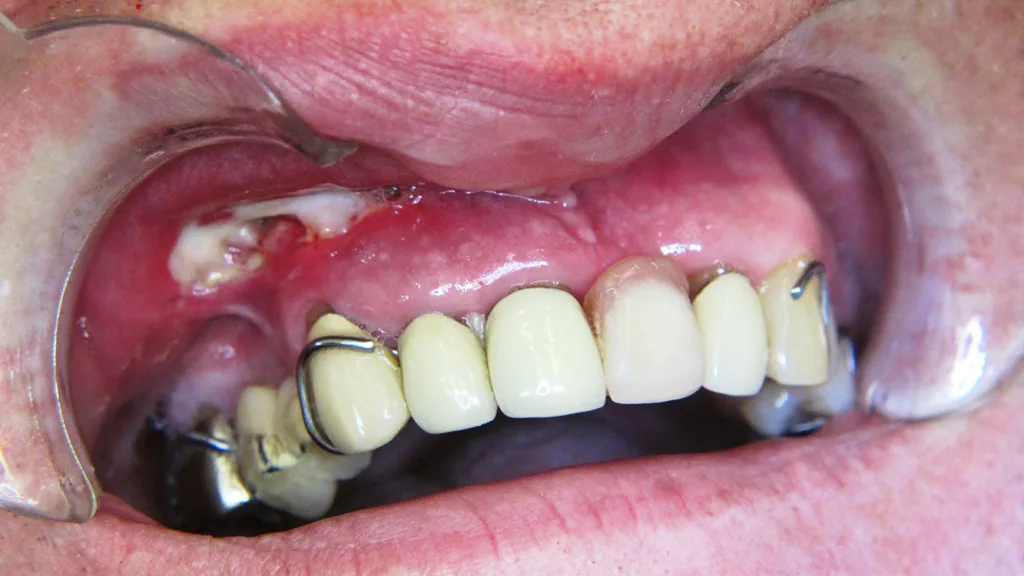 Hülsmann / Schäfer
Hülsmann / SchäferChlorhexidin
In der dermatologischen Literatur finden sich Hinweise auf allergische Reaktionen auf CHX, u.a. ein anaphylaktischer Schock. Aus der Endodontie sind keine Fallberichte bekannt. NaOCl und CHX können als sichere Desinfektionslösungen betrachtet werden [55,56].
Nickel-Titan-Instrumente
Obwohl nach Präparation mit NiTi-Instrumenten Spuren von Nickel im periapikalen Gewebe nachgewiesen wurden, liegen auch nach mehr als 30-jähriger Anwendung keine Berichte über allergische oder andere Unverträglichkeitsreaktionen vor. Vermutlich verantwortlich hierfür ist, dass das Nickel so an das Titan gebunden ist, dass es keine eigenständigen Reaktionen im Gewebe auslösen kann.
Es gibt keine Kontraindikation zur Anwendung von NiTi-Instrumenten bei Personen mit Nickelallergie. Bei apexnah frakturierten und belassenen NiTi-Instrumenten wurde im Laborversuch eine erhöhte Nickelkonzentration in Apexnähe gemessen. Aus präventiver Sicht ist eine Überinstrumentierung mit NiTi-Instrumenten zu vermeiden. Eine Entfernung apexnah frakturierter Instrumente ist in Erwägung zu ziehen [57].

(Para)formaldehyd
Die Substanz ist in einigen Devitalisationsmitteln und Sealern enthalten (Toxavit, N2, früher Endomethasone) oder wurde in Spuren während des Abbindevorgangs freigesetzt (AH 26). Es liegen zahlreiche Publikationen über schwere lokale (Urtikaria, Knochen- und Gewebenekrosen) und anaphylaktische Reaktionen auf formaldehydhaltige Präparate vor [58]. Formaldehydhaltige Präparate sollen allen endodontischen Fachgesellschaften (DGET, ESE, AAE) zufolge heute generell nicht mehr eingesetzt werden.
Medikamentöse Einlagen
Es liegt ein Fallbericht über eine allergische Reaktion mit Urtikaria, Pruritus und Fieber auf den Tetrazyklinanteil in Ledermix vor. Auch über eugenol- oder phenolhaltige Flüssigkeiten (ED 84) liegen Meldungen vor [59].
Wurzelkanalfüllmaterialien
Viele Sealer enthalten in unterschiedlichen Mengen zahlreiche Substanzen mit allergenem Potenzial, darunter Eugenol, Menthol, Trioxymethylene, Epoxy Bisphenol, Kolophonium, Perubalsam u.a. Es liegen mindestens zwölf Berichte über allergische Reaktionen auf Sealer mit Paraformaldehydzusatz vor. Die Reaktionen umfassen Anaphylaxie, Quincke-Ödem, Urtikaria, Angioödem und mehrfach anaphylaktische Schocks. Als Sealer mit allergenem Potenzial gelten eugenolbasierte Sealer, polyketonbasierte Sealer (z.B. Diaket), epoxidbasierte Sealer (z.B. AH 26, AH plus), Formaldehyd enthaltende Sealer (N2, Endomethasone, „Russian Red“ und Silber (Silberstifte) [55,57].
Nach Anwendung von AH Temp (Dentsply), einer kalziumhydroxidbasierten temporären Kanaleinlage, die 28% Polyethylenglycol enthält, kam es in mindestens zwei Fällen zu schweren anaphylaktischen Reaktionen, von denen eine tödlich endete [60]. Die gewöhnlich in der Endodontie verwendeten Materialien und Medikamente können im Hinblick auf allergische Reaktionen als sehr sicher angesehen werden, können im Einzelfall aber durchaus auch Allergien unterschiedlichen Schweregrades und Hypersensitivitäten verursachen. Die Inzidenz solcher Zwischenfälle ist aber äußerst niedrig.

Fazit
Für die in diesem Beitrag diskutierten allgemeinmedizinischen Probleme, Erkrankungen des hämatopoetischen Systems, Virenerkrankungen, Osteoporose und Allergien, sind jeweils Assoziationen zur Endodontie nachgewiesen. Dies kann die Inzidenz endodontischer Erkrankungen, aber auch Aspekte der Therapie betreffen. Nachweise für Kausalzusammenhänge liegen nicht vor. Bei allen Neupatienten/-innen muss daher eine sorgfältige Anamnese erhoben werden, die mögliche Vorerkrankungen, Medikationen, Allergien und eventuelle frühere Zwischenfälle bei Zahn- und Wurzelkanalbehandlungen erfasst. Im dritten Teil dieses Beitrags (ET ZMK 1-2 2026) geht es um die Zusammenhänge zwischen Endodontie und Chemotherapie, Lifestyle (Nikotin, Alkohol, Ernährung), Alter und Gender sowie deren Bedeutung für die endodontische Therapie.
 Entdecke CME Artikel
Entdecke CME Artikel  Entdecke Artikel mit Download
Entdecke Artikel mit Download 



 Mit Google einloggen
Mit Google einloggen
 Mit Facebook einloggen
Mit Facebook einloggen
Keine Kommentare.