|
Getting your Trinity Audio player ready...
|
 Patyna
PatynaDr. Michael Patyna, Poliklinik für Parodontologie und Zahnerhaltung der Universitätsmedizin Mainz ging in seinem Impulsvortrag zunächst auf die aktuellen (leitlinienbasierten) Empfehlungen zur häuslichen Biofilmkontrolle in der Parodontitistherapie und -prävention ein: Im Verlauf aller Therapiestufen soll bei Parodontitis-Patienten/-innen eine kontinuierliche Anleitung bezüglich adäquater häuslicher Mundhygienemaßnahmen erfolgen. Die häusliche Kontrolle des supragingivalen Biofilms kann demnach mechanisch und chemisch erreicht werden, d.h. durch Zähneputzen (manuell und/oder elektrisch), Reinigung der Zahnzwischenräume mit den entsprechenden Hilfsmitteln, vornehmlich mit Interdentalbürsten, sowie durch den Einsatz oraler Antiseptika [1].
Patyna empfiehlt den Einsatz von elektrischen Zahnbürsten, da diese im Vergleich zu Handzahnbürsten für viele Patienten/-innen einfach im Umgang sind. Darüber hinaus zeigen sie in Studien eine signifikant, aber geringfügig größere Reduktion gingivaler Entzündungszeichen gegenüber Handzahnbürsten [1]. Zudem weist ein Großteil der Parodontitis-Patienten/-innen eine ungenügende Mundhygiene auf, sodass durch den Einsatz elektrischer Zahnbürsten häufiger eine Verbesserung der klinischen Situation erreichbar ist.
Empfohlenes häusliches Biofilmmanagement
Unabhängig von der Art der verwendeten Zahnbürste sollte konsequent eine detaillierte professionelle Instruktion zu deren Anwendung erfolgen – mit besonderem Augenmerk auf die Etablierung einer Bürstensystematik unter Berücksichtigung einer vollständigen Reinigung der gesamten Zahnoberfläche und des Gingivarandbereiches. Die häusliche Mundhygiene kann somit durch eine individualisierte Instruktion unter Einbeziehung praktischer Übungen verbessert und bedarfsgerecht wiederholt werden [2,3].
Das Ziel der mechanischen Reinigung, alle mikrobiell besiedelten Flächen zu erreichen, kann im Alltag kaum mit der Zahnbürste allein erreicht werden. Daher werden weitere Hilfsmittel benötigt. Die häusliche Mundhygiene sollte durch die Anwendung von Interdentalraumbürsten ergänzt werden. Zusätzlich kann auch der indikationsgerechte Einsatz von (therapeutisch wirksamen) antibakteriellen Mundspüllösungen die mechanische Reinigung ergänzen. Damit kann der Biofilm zielgerichtet reduziert und somit einer Gingivitis vorgebeugt werden. Zahnseide sollte leitlinienbasiert bei Patienten/-innen nur eingesetzt werden, wenn Zahnzwischenräume nicht mit Interdentalbürsten zugängig sind.
Bei der Auswahl zusätzlicher Hilfsmittel sind nach Patyna zwei Aspekte zu berücksichtigen: Zum einen lokale Faktoren, zu denen die Erreichbarkeit der Reinigung, die Beachtung der Zahnanatomie und die Relation der gingivalen Entzündung zum Plaqueaufkommen zählen, und zum anderen allgemeine Faktoren, unter die die Punkte systemische Erkrankungen, Allgemeingesundheit, Gebrechlichkeit und eingeschränktes manuelles Geschick fallen [1].
Eine ausreichende Evidenz für den Einsatz zusätzlicher Hilfsmittel wie Probiotika, Präbiotika, antiinflammatorische Mittel und antioxidative Mikronährstoffe zur Kontrolle von gingivaler Entzündung bei Parodontitis-Patienten/-innen liege dagegen bisher nicht vor, so Patyna in seinen Ausführungen. Selbstredend sind die professionelle mechanische Plaquereduktion (PMPR) und die Reduktion retentiver Faktoren ein wichtiger Bestandteil der Biofilmkontrolle, um die parodontalen Zustände bei Parodontitis-Patienten/-innen zu stabilisieren bzw. zu verbessern und somit langfristig Zahnverlust vorzubeugen.
Lichtbasierte Verfahren in der Parodontitistherapie
Dioden-, CO2-, Nd:YAG-, Er:YAG- und ErCr:YSGG-Laser mit Wellenlängenbereichen zwischen 635 nm und 10.600 nm sind die am häufigsten in der Parodontitistherapie angewandten Lasertypen. Lichtbasierte Verfahren finden in der Praxis für die Dekontamination von Geweben und Oberflächen, zur Biostimulation (Wundheilung) und als adjuvante Therapie oder auch als Monotherapie (selektive Abtragung von Zahnstein) eine breite Anwendung [4,5]. Grundsätzlich wird zwischen antibakterieller photothermischer Therapie (aPTT) und antimikrobieller photodynamischer Therapie (aPDT) auf der Grundlage einer Laser-basierenden oder LED-basierenden PDT unterschieden. Das Prinzip der PDT kann als ein etabliertes lichtbasiertes Verfahren angesehen werden. Nötige Systemkomponenten sind neben der Lichtquelle (Laser oder LED) ein auf die Lichtquelle abgestimmter Farbstoff, der sogenannte Photosensitizer (z.B. Toluidinblau O, Methylenblau, Methylenblauderivat oder Indocyaningrün, Abb. 1).
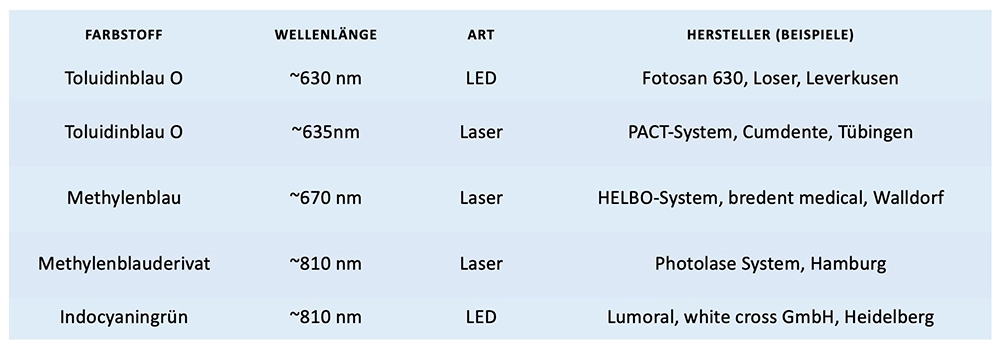 Patyna
PatynaDer zugrundliegende Mechanismus der Biofilmzerstörung basiert dabei auf zwei aufeinander aufbauenden Schritten: Als Erstes bindet sich der Photosensitizer zunächst an die Zielzellen (Bakterien), anschließend wird dieser mit dem passenden Licht einer bestimmten Wellenlänge (Laser oder LED) bestrahlt und es entsteht eine reaktive Form des Sauerstoffs, der die Bakterien lokal zerstören kann (Abb. 2).
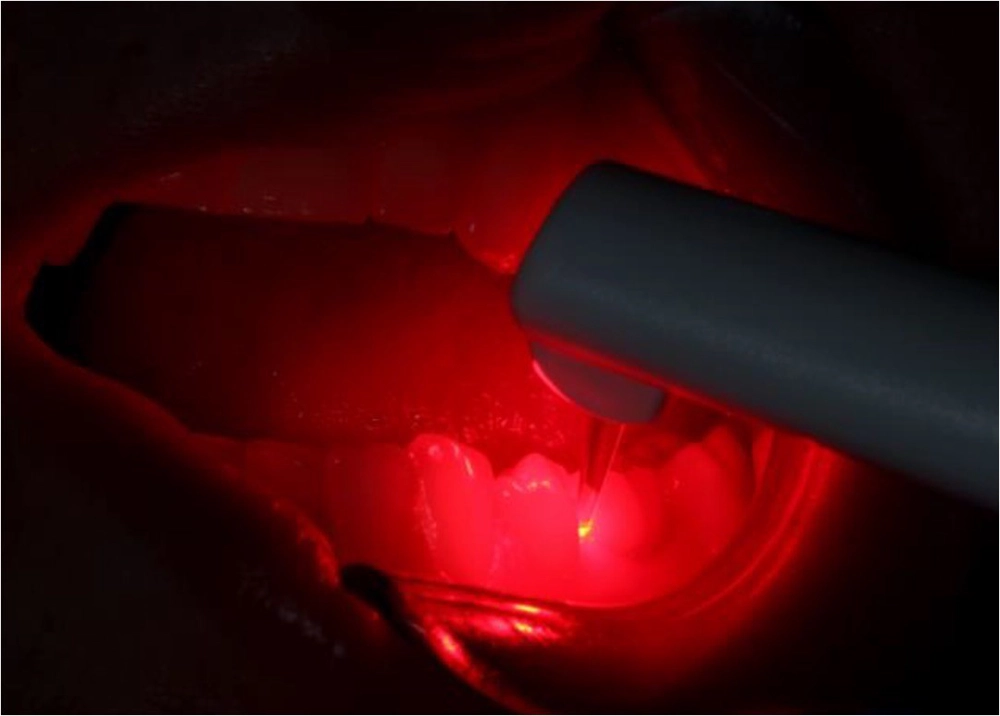 Patyna
PatynaEffektivität lichtbasierter Verfahren im Vergleich zu konventionellen Methoden
Einige Lasersysteme können in Abhängigkeit von Wellenlänge und Einstellungen subgingivalen Zahnstein entfernen und zudem antimikrobielle Effekte ausüben. Grundsätzlich kann man die meisten Systeme in einem Wellenlängenbereich von 2.780 bis 2.940 nm (Laser) und 810 bis 980 nm (Laser, LED) einordnen. Allerdings liegt sowohl für den adjuvanten Einsatz von Lasern als auch für die adjuvante aPDT nur unzureichende Evidenz vor, sodass deren Einsatz aktuell leitlinienkonform nicht empfohlen wird [1].
Basierend auf der aktuellen Diskussion der Evidenzbewertung für die Anwendung der aPDT in der Zahnarztpraxis im Vergleich zu konventionellen Methoden der Biofilmkontrolle merkte Patyna an, dass die Leitliniengruppe in Deutschland derzeit aufgrund der beträchtlichen Heterogenität der Studienlage eine generalisierte Empfehlung zur Anwendung der aPDT im Rahmen der Parodontitistherapie nicht erteilen kann. Dagegen kann nach dem Sondervotum des Bundesverbandes der implantologisch tätigen Zahnärzte in Europa (BDIZ/EDI) bei Vorliegen von Studien (peer-review) mit positiven klinischen Ergebnissen für ein photodynamisches Verfahren dessen adjuvanter Einsatz in der Zahnarztpraxis durchaus erfolgen – auch wenn eine generalisierte Empfehlung aufgrund der Datenlage nicht möglich ist.
Studie: Kombination von aPDT und Probiotika
Patyna berichtete weiter über eigene Untersuchungen zur Kombination von Behandlungsstrategien mit aPDT und Probiotika und deren Auswirkungen auf klinische und mikrobiologische Parameter in der Parodontaltherapie [6]. Dazu wurden in einer einfach verblindeten, randomisierten, kontrollierten, klinischen Studie im Parallelgruppendesign 48 Patienten/-innen (28 Frauen, 20 Männer) mit Parodontitis (Stadium II-III, Grad B) in drei Gruppen zu je 16 Probanden/-innen eingeteilt (Abb. 3). Bei allen drei Gruppen wurde ein subgingivales Débridement (SD) als Standardtherapie durchgeführt. Gruppe 2 erhielt zusätzlich eine einmalige aPDT (Fotosan® 630, CMS Dental, Kopenhagen, Dänemark) mit dem Photosensitizer Toluidinblau-O.
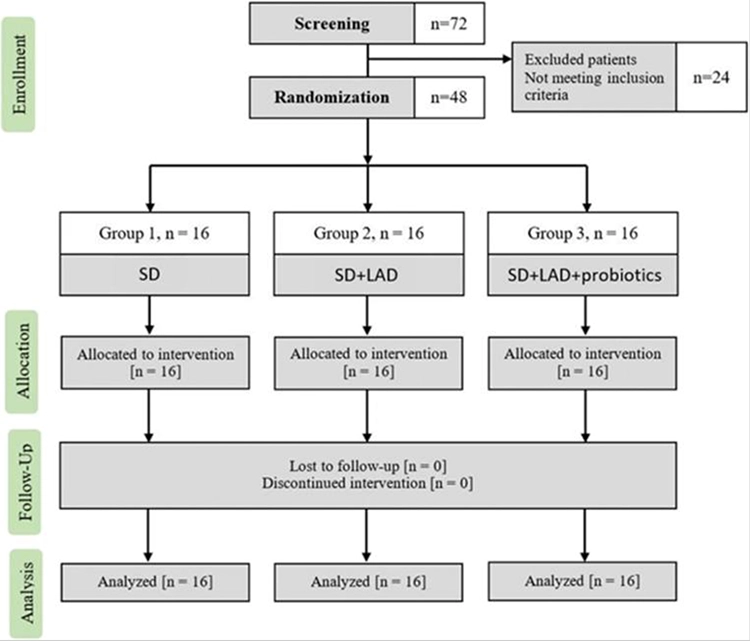 Patyna
PatynaBei Gruppe 3 wurde nach SD und aPDT-Anwendung ein probiotisches Gel (ProlacSan® Gel 1,2 ml, 6 x 109 CFU, CMS Dental, Kopenhagen, Dänemark/eine Kombination aus Lactobacillus brevis 7480 CECT und Lactobacillus plantarum 7481 CECT) einmalig subgingival instilliert. Darüber hinaus wurden die Probanden/-innen angewiesen, drei Monate lang täglich eine Lutschtablette einzunehmen. Es zeigte sich in den Follow-ups nach drei bzw. sechs Monaten, dass die einmalige Anwendung von aPDT als Zusatz zum SD keine klinischen (klinischer Attachmentverlust [CAL] und Taschensondierungstiefe [TST]) und mikrobiologischen Vorteile im Vergleich zur SD allein bot. Die Kombination SD, aPDT und Probiotika dagegen führte zur weiteren Verbesserung der inflammatorischen und mikrobiologischen Parameter. Das Bluten auf Sondierung (BAS/BOP) verringerte sich signifikant am stärksten in Gruppe 3 (zusätzliche Anwendung mit Probiotika) nach sechs Monaten.
Auch die allgemeine Studienlage zeigt weitestgehend ein stark heterogenes Bild hinsichtlich der Verbesserung der klinischen Parameter TST oder CAL nach aPDT-Anwendung, so Patyna weiter, allerdings ist häufig eine merkliche Reduzierung der lokalen Inflammation im Vergleich zur alleinigen subgingivalen Instrumentierung feststellbar. Dieser Effekt ist bei einmaliger aPDT-Anwendung jedoch zeitlich limitiert [7]. In diesem Kontext führte Patyna weiter aus, dass die aktuell verfügbare Literatur bezüglich der wiederholten Anwendung von aPDT ungenügend aufgestellt sei und hinsichtlich der Gegenüberstellung von einzelner und mehrfacher Anwendung der aPDT sehr unterschiedliche Erkenntnisse vorliegen: Ramanauskaite et al. (2021) berichteten, dass einzelne und mehrfache Anwendungen von aPDT nach SD gleichermaßen zur Reduktion von BOP im Vergleich zu SD allein führten [8]. Hingegen zeigten Sukumar et al. (2020) eine signifikant höhere Reduktion von parodontalen Pathogenen bei ergänzenden mehrfachen Anwendungen von aPDT [9].
Einordnung von Lumoral im Rahmen der Parodontitistherapie
Nachdem die bisher verfügbare aPDT weitgehend auf Behandlungen in der Praxis beschränkt und damit der Zugang einer wiederholten Anwendung erschwert ist, zeigen erste vorliegende Erkenntnisse zu Lumoral, dass häufig wiederholte Anwendungen durch die Patienten/-innen zuhause ein vielversprechender Ansatz sein können, um die mikrobielle Belastung dauerhaft zu verringern, so Patyna [10,11]. Auch an eigenen Patientenfällen konnte er bei wiederholter Anwendung von Lumoral, ergänzend zu bewährten häuslichen Mundhygienemaßnahmen, eine Besserung klinischer Parameter feststellen. Patienten/-innen berichteten dabei über das einfache Handling der Anwendung.
Patyna sieht in der Anwendung von Lumoral nach AIT (Antiinfektiöse Therapie) als therapieunterstützende häusliche Maßnahme einen potenziellen Mehrgewinn. Im Weiteren kann ein zielgerichteter Einsatz während der UPT (Unterstützende Parodontitistherapie) als ergänzende Maßnahme zur Sicherung des Therapieergebnisses sinnvoll sein – insbesondere in den Zeiträumen zwischen den bedarfsgerechten UPT-Terminen mit professioneller mechanischer Plaquereduktion (PMPR). Seiner Meinung nach kann die tägliche häusliche Anwendung mit Lumoral zusätzlich zur klinischen Wirkung einen positiven psychologischen Effekt ausüben, denn „die PA-Therapie verläuft ja, wie wir alle wissen, über einen längeren Zeitraum. Das kann dazu führen, dass die Patienten/-innen wieder in alte Verhaltensmuster fallen“, so Patyna. Durch die Ergänzung der häuslichen Mundhygienemaßnahmen mit Lumoral können Patienten/-innen mit parodontaler Erkrankung weiter daran erinnert und motiviert werden, über das normale Maß hinaus für ihre orale Gesundheit zu sorgen. Sein Fazit: Lumoral und seine zugrundliegende Methode haben Potenzial für die Anwendung bei Parodontitis-Patienten/-innen zum langfristigen Erhalt der parodontalen Gesundheit.
 Entdecke CME Artikel
Entdecke CME Artikel  Entdecke Artikel mit Download
Entdecke Artikel mit Download 

 Mit Google einloggen
Mit Google einloggen
 Mit Facebook einloggen
Mit Facebook einloggen
Keine Kommentare.