|
Getting your Trinity Audio player ready...
|
Aus bisherigen Studien zeigen sich Hinweise, die für mögliche Assoziationen zwischen bakteriellen Profilen und dem Verlauf einer oralen Mukositis im Rahmen von Chemo- und/oder Strahlentherapien sprechen. Grundsätzlich zeigt sich ein deutlicher Zusammenhang zwischen Mundgesundheit und dem Risiko für orale Mukositis: Eine schlechte Mundhygiene, Karies sowie endodontische und parodontale Erkrankungen gelten als Risikofaktoren. Von zahnmedizinischer Seite sollten demnach in diesem Kontext kariöse Läsionen versorgt, scharfe Kanten an Zähnen und Zahnersatz geglättet, nicht erhaltungsfähige Zähne extrahiert, Prothesendruckstellen vermieden sowie eine präventive Betreuung mit speziellem Mundhygieneprotokoll und engmaschigen Kontrollen etabliert werden.
Orale Mukositis als Nebenwirkung der Tumortherapie
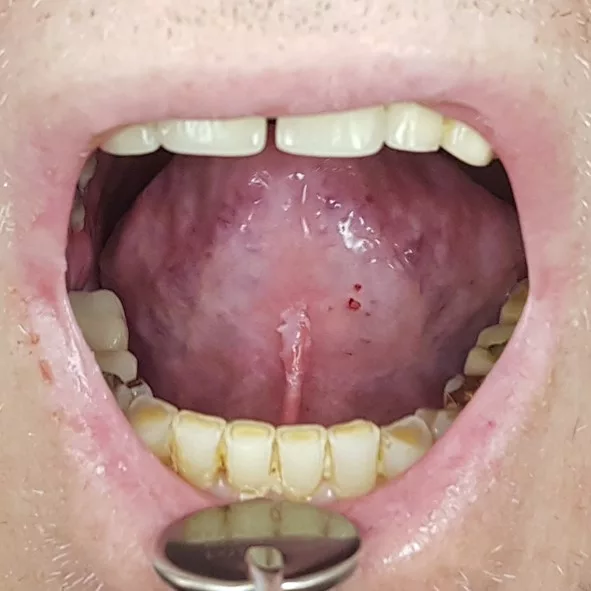
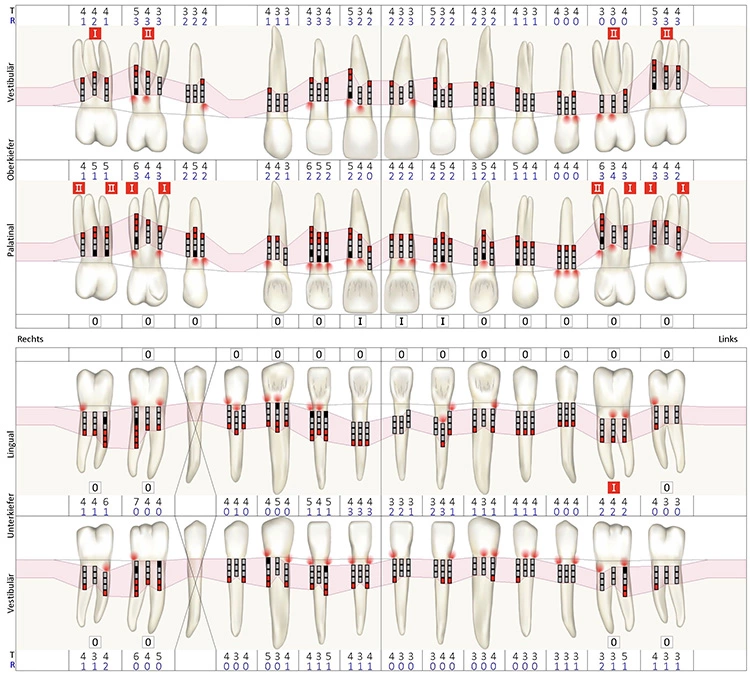
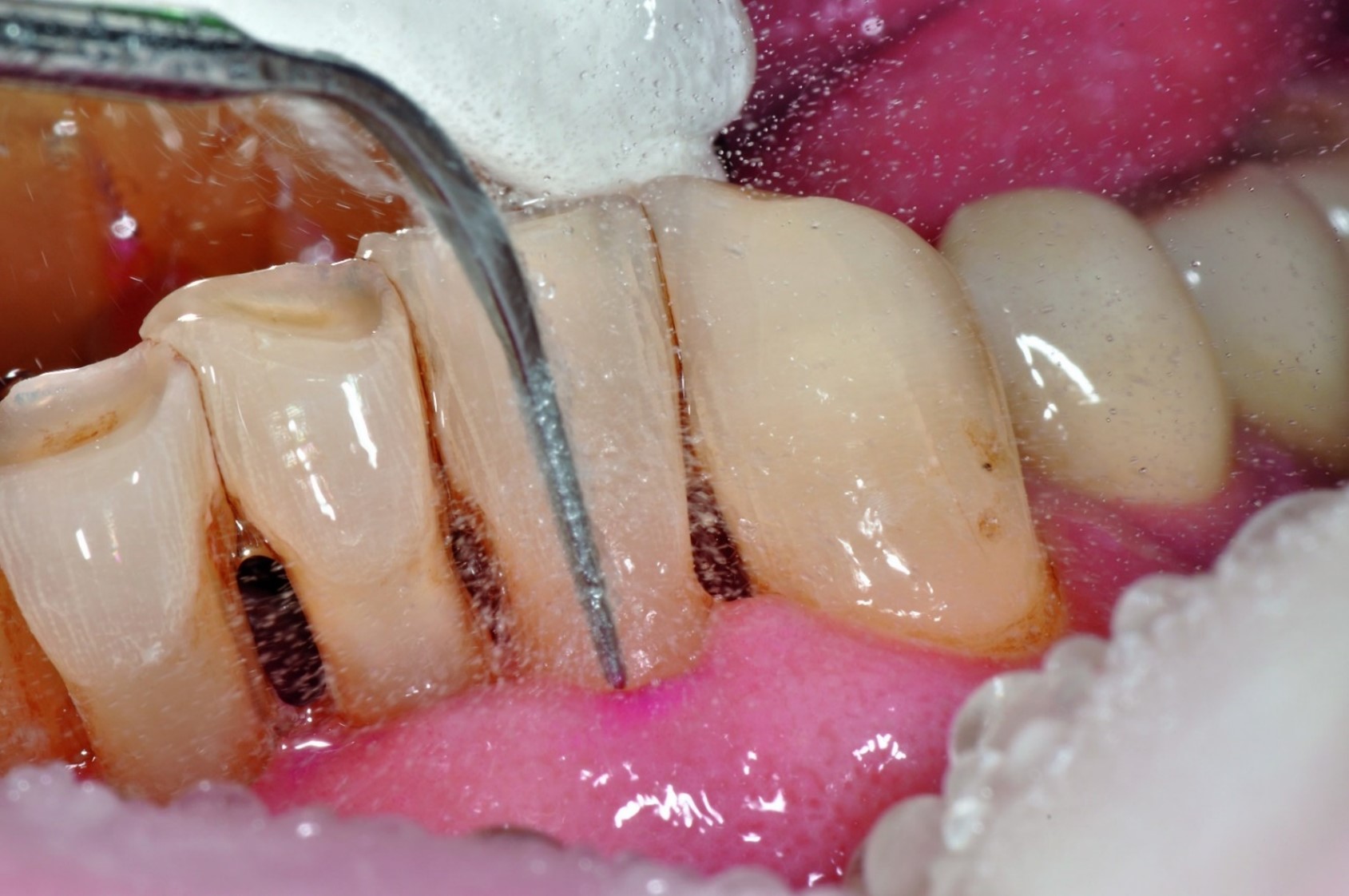
Die orale Mukositis stellt eine der häufigsten Komplikationen im Rahmen onkologischer Behandlungen dar: Sie ist gekennzeichnet durch Ausbildung von Ulzerationen an der Mundschleimhaut, die mit einer erhöhten Anfälligkeit für mikrobielle Kolonisation einhergehen. Patienten/-innen während hämatopoetischer Stammzelltransplantation (HSZT) sind besonders häufig betroffen – bis zu 80% entwickeln eine orale Mukositis, wobei etwa 40% einen schweren Ausprägungsgrad aufweisen [1,2]. Nach dem Klassifikationssystem der WHO wird die orale Mukositis in fünf Schweregrade unterteilt. Grad 0 entspricht dabei einer intakten Mundschleimhaut ohne Veränderungen. Die Grade 1 bis 4 sind in der Abbildung 1 dargestellt.
 Dr. Dr. Kyrill Schoilew
Dr. Dr. Kyrill Schoilew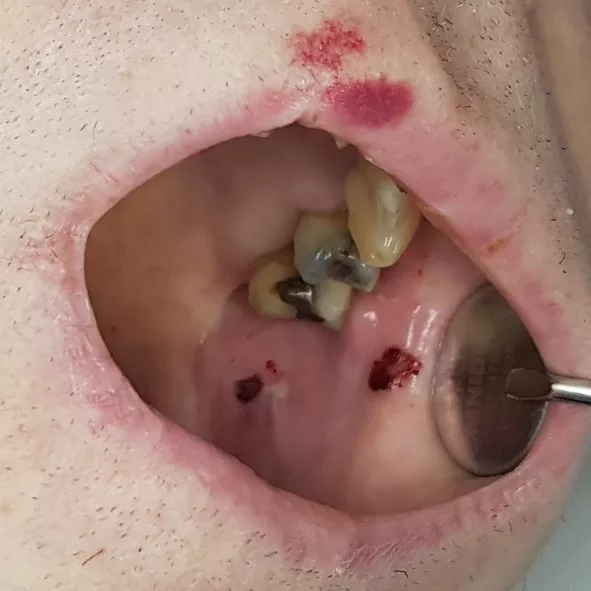 Dr. Dr. Kyrill Schoilew
Dr. Dr. Kyrill Schoilew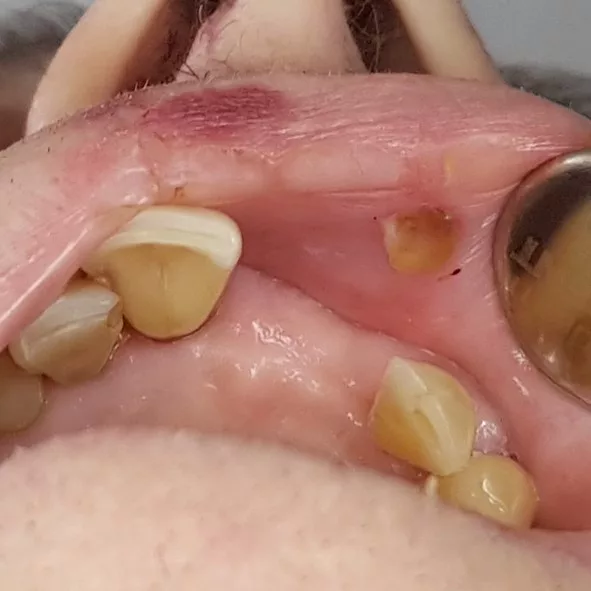 Dr. Dr. Kyrill Schoilew
Dr. Dr. Kyrill Schoilew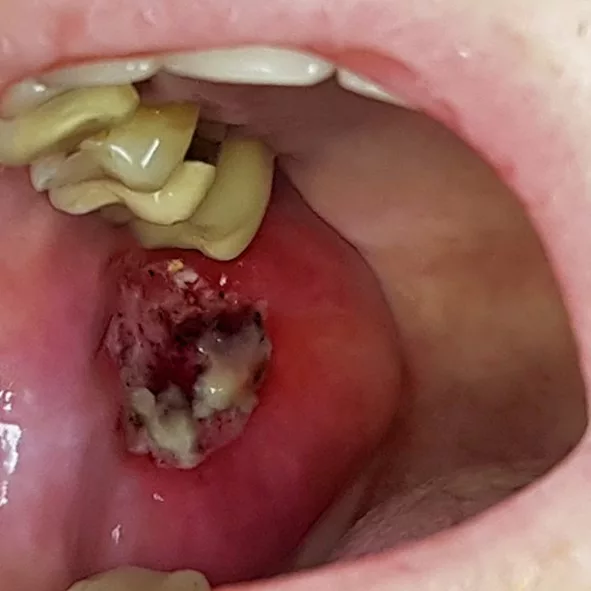 Dr. Dr. Kyrill Schoilew
Dr. Dr. Kyrill SchoilewDer Verlust der Integrität der Mundschleimhaut kann für die Betroffenen mit starken Schmerzen verbunden sein, die selbst mit Opioiden nur unzureichend zu lindern sind. In Patientenbefragungen führt orale Mukositis die Liste der am meisten gefürchteten therapieassoziierten, unerwünschten Nebenwirkungen während Chemo- bzw. Radiotherapie an [3]. Die schmerzhaften Läsionen beeinträchtigen die Nahrungsaufnahme stark bzw. können diese für die Betroffenen unmöglich machen. Zur Gewährleistung einer adäquaten Kalorienaufnahme kann die Anlage von Ernährungssonden oder eine parenterale Ernährung erforderlich sein [3,4]. Durch Verlust der physiologischen Barrierefunktion der Schleimhaut steigt zudem das Risiko für sekundäre Infektionen wie Bakteriämien und Sepsis für die ohnehin immundefizienten Patienten/-innen zusätzlich [1,2,5,6].
Insgesamt stellt die orale Mukositis unter anderem einen der Hauptgründe für verlängerte Krankenhausaufenthalte dar. Ein damit einhergehender Anstieg von Krankenhauskosten verdeutlicht die gesundheitsökonomischen Implikationen der oralen Mukositis [7,8] – so werden die zusätzlichen Behandlungskosten allein durch orale Mukositis infolge von Radiochemotherapie bei Patienten/-innen mit Kopf-Hals-Tumoren und Lungenkrebs auf mehr als 17.000 US-Dollar pro Patient/-in beziffert [4,9].
Pathogenese
Im vergangenen Jahrzehnt konnten wesentliche Einblicke in die Pathobiologie der oralen Mukositis generiert werden. Während traditionell der direkte therapieassoziierte Zelltod epithelialer Stammzellen als Hauptursache der oralen Mukositis galt, verorten aktuell vorherrschende Modelle die Pathogenese in einer komplexen Interaktion zwischen epithelialen und bindegewebigen Kompartimenten. Zugrundeliegende pathobiologische Vorgänge werden in einem fünfstufigen Prozess charakterisiert, der durch Expression proinflammatorischer Zytokine gekennzeichnet ist und in Gewebeschädigung durch kombinierte Apoptose und Gewebenekrose resultiert [1,2,4]. Bleibt eine Infektion der ulzerierten Mukosa aus, nimmt die orale Mukositis einen selbstlimitierenden Verlauf. Die Inzidenz lokaler oder systemischer Infektionen ist jedoch sehr hoch [10]. Der Verlust der Schleimhautintegrität mit einhergehender Zunahme der mukosalen Permeabilität begünstigt eine mikrobielle Kolonisation und damit die Ausbildung aktiver Läsionen – in dieser Phase sind myeloablatierte Patienten/-innen durch ein erhöhtes Risiko für Bakteriämie und Sepsis besonders gefährdet. Obgleich die Rolle von Mikroorganismen in der Pathogenese der oralen Mukositis bereits seit Jahrzehnten Gegenstand der Forschung ist, ist deren Einfluss auf den Verlauf der oralen Mukositis nach wie vor weitgehend ungeklärt.
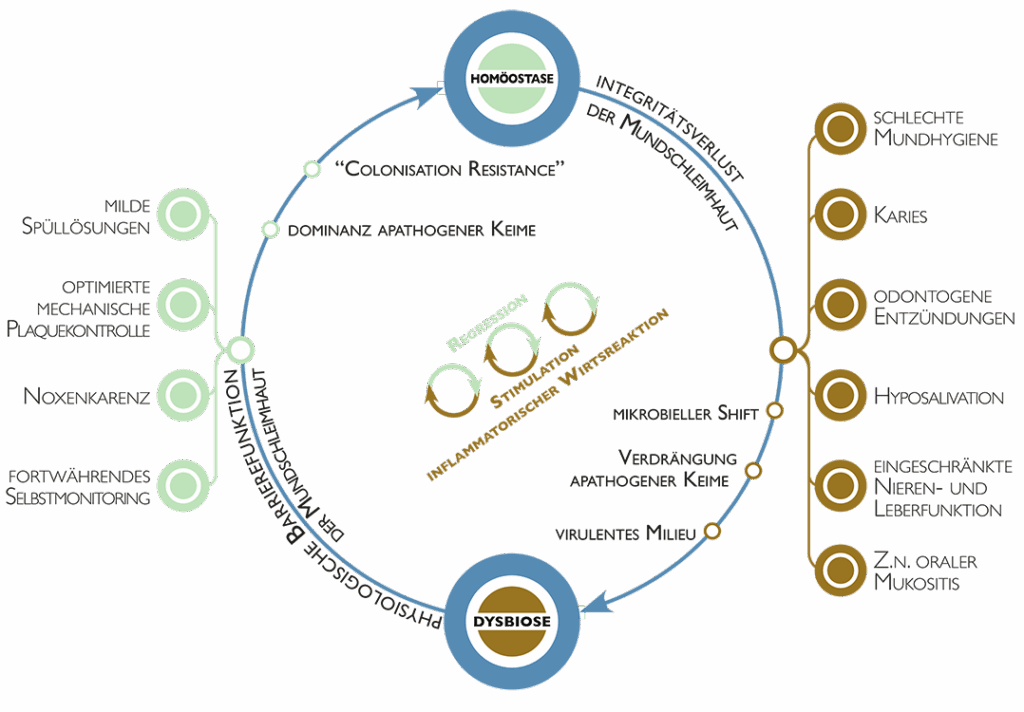
Der Zustand oraler Gesundheit wird als Gleichgewicht zwischen Wirt und oralem Mikrobiom in einer sogenannten Homöostase angesehen. Eine mikrobielle Homöostase schützt vor Kolonisierung mit exogenen und oft pathogenen Mikroorganismen (colonisation resistance), fördert die normale Entwicklung physiologischer und immunologischer Prozesse und trägt auch darüber hinaus zur systemischen Gesundheit des Wirtes bei [11]. Demgegenüber kann eine Störung der mikrobiellen Homöostase durch veränderte intrinsische und extrinsische Faktoren zu einer mikrobiellen Dysbiose durch selektive Begünstigung potenziell pathogener Mikroorganismen führen – es entstehen Nischen mit virulentem Milieu.
Vor diesem Hintergrund ist ein deutlicher Zusammenhang zwischen Mundgesundheit und dem Risiko für orale Mukositis auszumachen – eine schlechte Mundhygiene, Karies, endodontische Fokusse und Parodontalerkrakungen gelten als Risikofaktoren [12,13]. Als weitere patientenbezogene Risikofaktoren erhöhen ein reduzierter Speichelfluss, bestimmte genetische Faktoren, eine eingeschränkte Nieren- und Leberfunktion sowie eine vorausgegangene Krebstherapie das Auftreten und die Ausprägung der oralen Mukositis [14–16] (Abb. 2). Therapiebezogene Risikofaktoren sind hingegen in Abhängigkeit von Art und Dosis der Tumortherapie zu verorten – insbesondere Hochdosischemotherapie und allogene Stammzelltransplantation gehen mit einem hohen Risiko für eine schwere orale Mukositis einher [6,14–16]. Grundsätzlich konnte festgestellt werden, dass zytotoxische Therapien in erheblichem Maße das ökologische Gleichgewicht beeinflussen und zu Shifts in der oralen Mikroflora führen [17,18].
 Dr. Dr. Kyrill Schoilew
Dr. Dr. Kyrill SchoilewPrävention und Therapie
Eine Suche nach Reizen in der Mundhöhle mit ggf. bedarfsgerechter zahnärztlicher Sanierung gilt als sogenannter „standard of care“zur Prävention einer oralen Mukositis bei Patienten/-innen vor Tumortherapie. Die medizinischen Fachgesellschaften empfehlen in diesem Zusammenhang etwa die Versorgung kariöser Läsionen, die Glättung scharfer Kanten an Zähnen und Zahnersatz, ggf. die Extraktion nicht erhaltungsfähiger Zähne, die Sanierung von Schleimhautdefekten, die Behandlung und Prävention von Prothesendruckstellen sowie eine bedarfsgerechte Fluoridierung [16]. Es konnte gezeigt werden, dass eine Sanierung odontogener Infektionen bei Patienten/-innen vor HSZT mit einer Senkung systemischer Infektionen um etwa 30% und einer zusätzlichen Mortalitätsreduktion von 18 pro 10.000 behandelter Patienten/-innen einhergeht [19,20].
Darüber hinaus finden sich vielzählige Maßnahmen zur Prophylaxe und Therapie oraler Mukositis während onkologischer Behandlungen [16, 21–24]. Hierbei handelt es sich jedoch ausschließlich um allgemeine Maßnahmen oder symptomatische Therapien – kausale Strategien stehen bislang noch aus. In diesem Zusammenhang wird die Bedeutsamkeit präventiver Maßnahmen offenbar: Eine standardisierte Mundhygiene wird demnach als Grundpfeiler in allen Altersgruppen und bei allen Tumorbehandlungen mit einem Risiko für orale Mukositis empfohlen [22,25–28]. Die Ergebnisse einer systematischen Übersichtsarbeit unterstreichen die präventive Wirkung oraler Mundhygieneprotokolle und deuten ebenso auf positive Effekte bei Fortführung der Mundhygieneprotokolle nach Ausbildung einer oralen Mukositis [22,28]. Es wird angenommen, dass das orale Mikrobiom über Stimulation einer inflammatorischen Wirtsreaktion Inzidenz und Schweregrad der oralen Mukositis beeinflussen kann [10,29,30]. In diesem Kontext wird die Rationale der positiven Effekte von Mundhygieneprotokollen in einer Modulation der oralen Mikroflora vermutet, welche wiederum mit einer verringerten Immunreaktion des Wirts einhergeht [22].
Auch wenn die bislang untersuchten Mundhygieneprotokolle im Detail mitunter voneinander abweichen, stimmen sie in wesentlichen, nachfolgend aufgeführten Bestandteilen überein [21,22,27,28]:
- individuelle Mundhygiene
– regelmäßige Mundspülung mit milden Spüllösungen
– Zähneputzen mit weicher Zahnbürste, die regelmäßig ausgetauscht werden sollte
– Interdentalraumhygiene mit Zahnseide und/oder Interdentalraumbürsten
– Noxenkarenz (Tabak, Alkohol, scharfe oder sehr heiße Speisen, säurehaltige Lebensmittel)
– fortwährende Selbstbeobachtung auf Läsionen der Mundschleimhaut - risikoadaptierte Präventionsmaßnahmen durch den Zahnarzt
- engmaschiges klinisches Monitoring
Dementsprechend sollte bereits im Rahmen der zahnärztlichen Abklärung von Risikofaktoren ein umfassendes Mundhygienetraining unter Instruktion und Motivation des Patienten zur Etablierung einer sorgfältigen Mundhygiene erfolgen.
Mikrobiom und Mukositis
Untersuchungen des oralen Mikrobioms von Patienten/-innen unter HSZT sind gänzlich rar, erste Studien liefern jedoch wichtige Anhaltspunkte zum Einfluss der oralen Mikroflora in diesem Bereich: In einer Untersuchung von 13 Mikroorganismen mittels qPCR an 49 Patienten/-innen unter HSZT konnte Porphyromonas gingivalis im Besonderen als positiver prädiktiver Faktor für orale Ulzerationen ausgemacht werden, aber auch P. micra, T. denticola, F. nucleatum, C. glabrata und C. kefyr wiesen Assoziationen mit oralen Läsionen auf [31]. In einer Untersuchung des Speichelmikrobioms von 61 Patienten/-innen mit Fanconi-Anämie (davon 53 Patienten/-innen bei Zustand nach HSZT) konnten Assoziationen zwischen Streptococcus, Haemophilus, Aggregatibacter, Selenomonas, Capnocytophaga und Corynebacterium und schweren Formen einer oralen Mukositis (Grad 3–4) festgestellt werden [32]. Diese Befunde stützen die Annahme, dass spezifische bakterielle Profile einen wesentlichen Einfluss in der Pathogenese der oralen Mukositis haben könnten.
Grundsätzlich ist die Mukositis jedoch nicht nur auf den Mund- und Rachenraum beschränkt, sondern kann auch im gesamten Verdauungstrakt mit Schleimhautentzündungen einhergehen. Die Rolle des intestinalen Mikrobioms bei der Pathophysiologie der gastrointestinalen Mukositis ist ebenfalls nur ansatzweise erforscht. Eine Analyse von Stuhlproben von 28 Patienten/-innen vor und nach allogener Stammzelltransplantation mittels 16S rRNA Sequenzierung zeigte eine deutliche mit gastrointestinaler Mukositis einhergehende taxonomische und funktionale Dysbiose des intestinalen Mikrobioms [33]. Dieselbe Arbeitsgruppe untersuchte die Rolle des Darmmikrobioms als Prädiktor für Infektionen der Blutbahn während allogener Stammzelltransplantation. Patienten/-innen, deren intestinales Mikrobiom vor Initiation der Stammzelltransplantation eine geringere Diversität sowie eine verminderte Abundanz bestimmter Taxa (so etwa Barnesiellaceae, Coriobacteriaceae, Faecalibacterium, Christensenella, Dehalobacterium, Desulfovibrio und Sutterella) aufwies, entwickelten demnach im Verlauf häufiger Bakteriämien und Blutbahninfektionen. Ausgehend davon wies ein entsprechend entwickelter Risikoindex eine Sensitivität sowie eine Spezifität von jeweils 90% auf [34].
Orale Bakterien kolonisieren den gesunden Darm im Allgemeinen nur in geringem Maße [35]. Erhöhte Konzentrationen von Mikroorganismen oralen Ursprungs finden sich indessen etwa im Darmmikrobiom von Patienten/-innen mit chronisch-entzündlichen Darmerkrankungen [36,37], HIV-Infektion [38,39], Leberzirrhose [40,41] und Darmkrebs [42]. So zeigten sich etwa starke Korrelationen zwischen der Anwesenheit von Veillonellaceae und Fusobacteriaceae im Mikrobiom der intestinalen Mukosa sowie dem Krankheitsstatus von Morbus Crohn [36]. Die typischen oralen Bakterien Rothia, Streptococcus, Neisseria, Prevotella und Gemella wiesen im Darmmikrobiom von Patienten/-innen mit Colitis ulcerosa, primär sklerosierender Cholangitis und gastroösophagealem Reflux eine statistisch signifikant höhere Abundanz im Vergleich zu gesunden Kontrollprobanden auf [37]. In tierexperimentellen Untersuchungen konnte direkt nachgewiesen werden, dass P. gingivalis[43,44] und Klebsiella spp. [37] eine Dysbiose des Darmmikrobioms und eine abberante Aktivierung des intestinalen Immunsystems sowie weitere inflammatorische Vorgänge in verschiedenen Geweben und Organen hervorrufen können. In diesem Zusammenhang wird neuerdings die Rolle der Mundhöhle als Reservoir für potenzielle orale Pathobionten diskutiert [37]. Assoziationen zwischen einer ektopen Kolonisierung des Darms mit Mikroorganismen oralen Ursprungs und gastrointestinaler Mukositis sind bislang nicht untersucht worden.
Insgesamt ist anzunehmen, dass ein besseres Verständnis der Rolle des Mikrobioms sowie spezifischer bakterieller Profile nicht nur auf diagnostischer Ebene von Relevanz sein könnte, sondern auch therapeutische Implikationen im Zusammenhang mit oraler und gastrointestinaler Mukositis hätte [30,34].
Ausblick
Bisher sind spezifische präventive Konzepte zum Erhalt der Mundgesundheit bei Risikogruppen in der Zahnmedizin unterrepräsentiert. In der Zahnmedizin ist die Identifikation neuartiger prognostischer Marker notwendig und gerade für Hochrisikopatienten/-innen von hoher klinischer Relevanz. Ausgehend vom aktuellen Stand der Forschung ist es für die Zahnheilkunde von hoher Relevanz prospektive, longitudinale Studien durchzuführen. Hierbei ist von besonderem Interesse, welchen Einfluss eine allogene Stammzelltransplantation auf die Zusammensetzung des oralen und intestinalen Mikrobioms hat und welche oralen Keime auch im intestinalen Mikrobiom nachweisbar sind.
Für die klinische Praxis wären etwaige Assoziationen zwischen spezifischen oralen und intestinalen Mikrobiomprofilen und dem Schweregrad einer Mukositis von besonderer Bedeutung, um mögliche Cluster pathogener Keime zu identifizieren, die sich möglicherweise auf die Krankheitsausprägung auswirken. Diese Erkenntnisse könnten bestenfalls als Ansatzpunkte zur Entwicklung zielgerichteter Therapien beitragen. Zusätzlich kann durch die Identifikation neuer potenzieller Risikoindikatoren eine Grundlage für weitere translationale Untersuchungen in Medizin und Zahnmedizin geschaffen werden, die schließlich zur Entwicklung zielgerichteter individueller Präventionsstrategien für Hochrisikopatienten/-innen beitragen kann.
Weitere Inhalte zum Themenschwerpunkt:
 Entdecke CME Artikel
Entdecke CME Artikel  Entdecke Artikel mit Download
Entdecke Artikel mit Download 




 Mit Google einloggen
Mit Google einloggen
 Mit Facebook einloggen
Mit Facebook einloggen
Keine Kommentare.