|
Getting your Trinity Audio player ready...
|
Die Revitalisierung, Revaskularisierung oder heutzutage eher als „regenerative endodontische Therapie“ (RET) bezeichnet, ist eine neuartige Behandlungsoption, die einen biologischen Ansatz zur Behandlung von avitalen bleibenden Zähnen mit nicht abgeschlossenem Wurzelwachstum bietet [1]. Diese Alternativmethode zur traditionellen Apexifikationstechnik ermöglicht ein weiteres Wurzelwachstum, eine Revaskularisierung des Wurzelkanals, die Zunahme der Wurzelwandstärke und die Bildung eines mehr oder weniger physiologischen Apex [2]. Das Konzept der Geweberegeneration im Wurzelkanal wurde erstmals in den 1960er-Jahren bei Dr. Nygaard-Ostby aufgezeigt [3].
Im Jahr 2001 haben Iwaya et al. den ersten Fall der Revaskularisierung veröffentlicht, der nach alleiniger Wurzelkanaldesinfektion eine weitere Wurzelentwicklung eines nekrotischen Unterkieferprämolaren mit apikaler Parodontitis zeigte [4]. Im Jahr 2004 führten Banchs und Trope ein modifiziertes Protokoll ein, das nach ausgiebiger Spülung mit 5,25%igem NaOCl und Verwendung einer antibiotischen Paste als temporäre medikamentöse Einlage die Ausbildung eines sterilen Blutkoagels innerhalb des Wurzelkanals bewirkte [5]. Diese bahnbrechenden Fälle gaben den Anstoß für die weitere Forschung auf dem Gebiet der regenerativen Endodontie. In Folge wurden verschiedene antibiotische Mischungen, Kalziumhydroxidpräparate, Kanalspüllösungen und u.a. EDTA oder PRP, PRF als Alternative zum Blutkoagel erfolgreich ausprobiert [6,7]. Im Jahre 2013 schlug die American Association of Endodontists (AAE) ein Standardprotokoll für regenerative endodontische Prozeduren vor, welches jeweils 2016, 2018 und 2021 aktualisiert wurde [8]. Das Behandlungsprotokoll unserer Praxis basiert auf den Revitalisierungsrichtlinien der Europäischen Gesellschaft für Endodontologie, die 2016 veröffentlicht wurden [9].
Auf diese Weise entwickelten sich die regenerativen endodontischen Verfahren seit Anfang der 2000er-Jahre von einer eher experimentellen Behandlung bis hin zur Methode der Wahl für avitale Zähne mit weniger als zwei Drittel des Wurzellängenwachstums [10]. Die letzte systematische Überprüfung und Metaanalyse von Swaikat et al. im Jahre 2023 zeigte eine hohe Überlebens- und Erfolgsrate von 93,8% bzw. 88,3% bei der Behandlung traumatisierter unreifer nekrotischer bleibender Zähne mit RET-Techniken [11]. Dementsprechend ist die Effizienz der RET vergleichbar mit der einer Apexifikation mit einem hydraulischen Kalziumsilikatzement. Torabinejad et al. konnten Erfolgsraten der Apexifikation von 94,6% und 91,3% bei der Revitalisierung zeigen [12]. Die Veröffentlichung von Chisini et al. ergab klinische Erfolgsraten von 90,6% in der Apexifikationsgruppe und 87,9% in der Revaskularisierungsgruppe [13]. Trotz der relativ kurzen durchschnittlichen Beobachtungszeiträume in diesen Studien, die von 16,7 bis 23,2 Monaten variierten, zeigten Schmoeckel et al. auch gute langfristige Ergebnisse einer RET von bis zu acht Jahren nach der Behandlung [1].
Das Konzept der Revitalisierung lässt vermuten, dass Stamm- und Vorläuferzellen aus Pulparesten, dem Periodont und der apikalen Papille (SCAP) zur Wiederbesiedlung der sterilisierten Pulpahöhlen beitragen können [2]. Dieses Verfahren stammt aus Studien zu Zahntraumen, die zeigten, dass bei rechtzeitig replantierten, avulsierten Zähnen mit noch offenem Apex deren Vitalität wiederhergestellt und ein Nachweis einer weiteren Wurzelentwicklung erbracht werden konnte [6,14,15]. Wichtig ist, dass die Regenerationsfähigkeit der Pulpa direkt vom Stadium der Wurzelentwicklung und dem Durchmesser des Foramen apicale abhängt. Die besten Heilungsraten ergaben sich bei einem Foramen apicale > 1 bis 1,5 mm [6,14–17]. Die Idee, dass das entstehende Blutkoagel innerhalb der Pulpahöhle Stammzellen enthält, die dann eine neue Pulpa bilden können, klingt verlockend, jedoch gelingt die perfekte Regeneration dadurch leider nicht [18].
Histologische Untersuchungen zeigen, dass es anstatt einer Wiederherstellung der ursprünglichen Architektur und Funktion des Pulpagewebes meist zur Bildung von ektopischem Gewebe im Wurzelkanal kommt, insbesondere von fibrösem Gewebe, Zement oder Knochen. Letzten Endes ist aber eine Obliteration des Wurzelkanalsystems möglich [17–19]. Obwohl dies in vielen Fällen auch als klinischer Behandlungserfolg gewertet werden kann, findet hier lediglich ein reparativer Prozess statt und keine wirkliche Regeneration [20]. Dennoch kann diese „biologische Wurzelkanalfüllung“ nützliche Eigenschaften entwickeln und bei jungen Patienten/-innen mit nicht abgeschlossenem Wurzelwachstum zur Stärkung der dünnen Wurzelwände führen [18]. Schlussendlich erhält dieser Zahn bei Kindern und Jugendlichen zumindest über viele Jahre effektiv den Knochen, bis dann zu einem späteren Zeitpunkt wesentlich problemloser über eine reguläre Wurzelkanalbehandlung oder auch eine Implantation nachgedacht werden kann.
Fallbericht
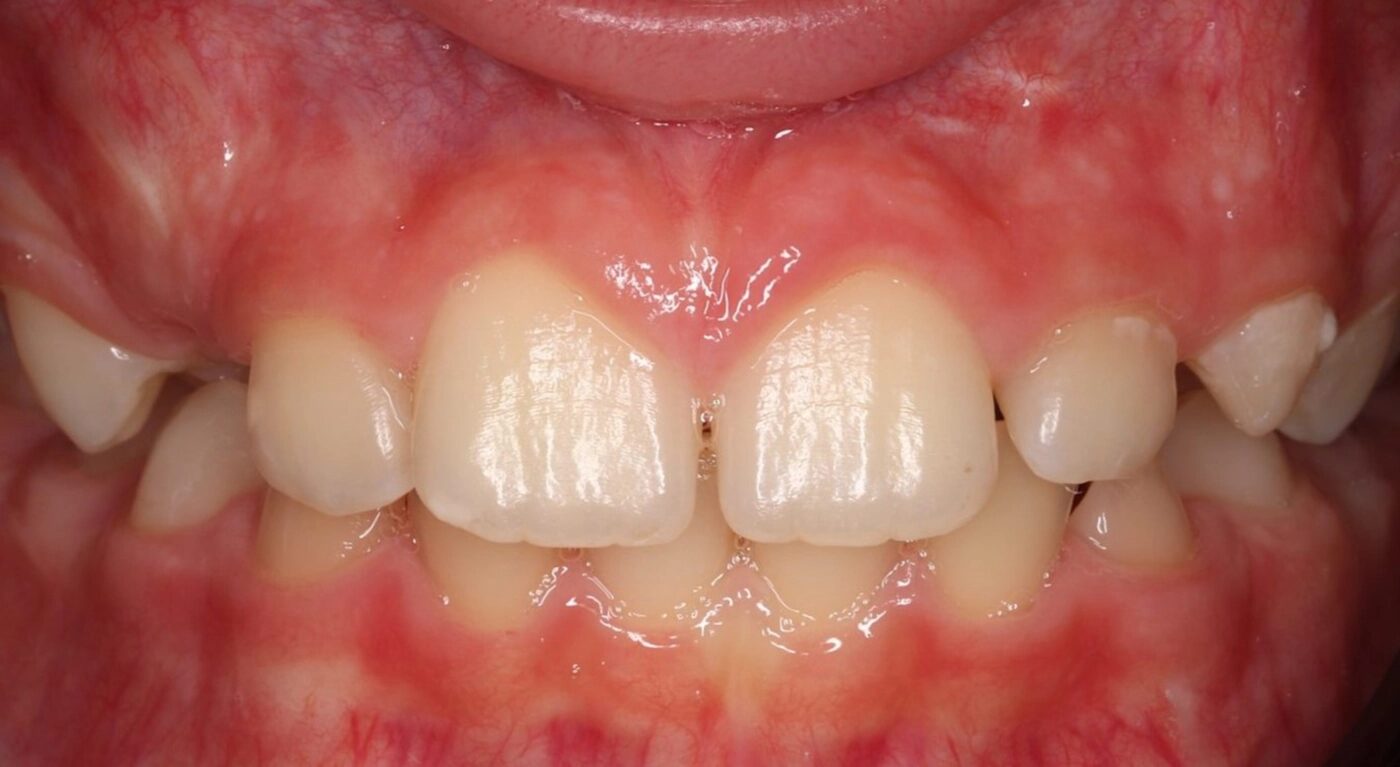
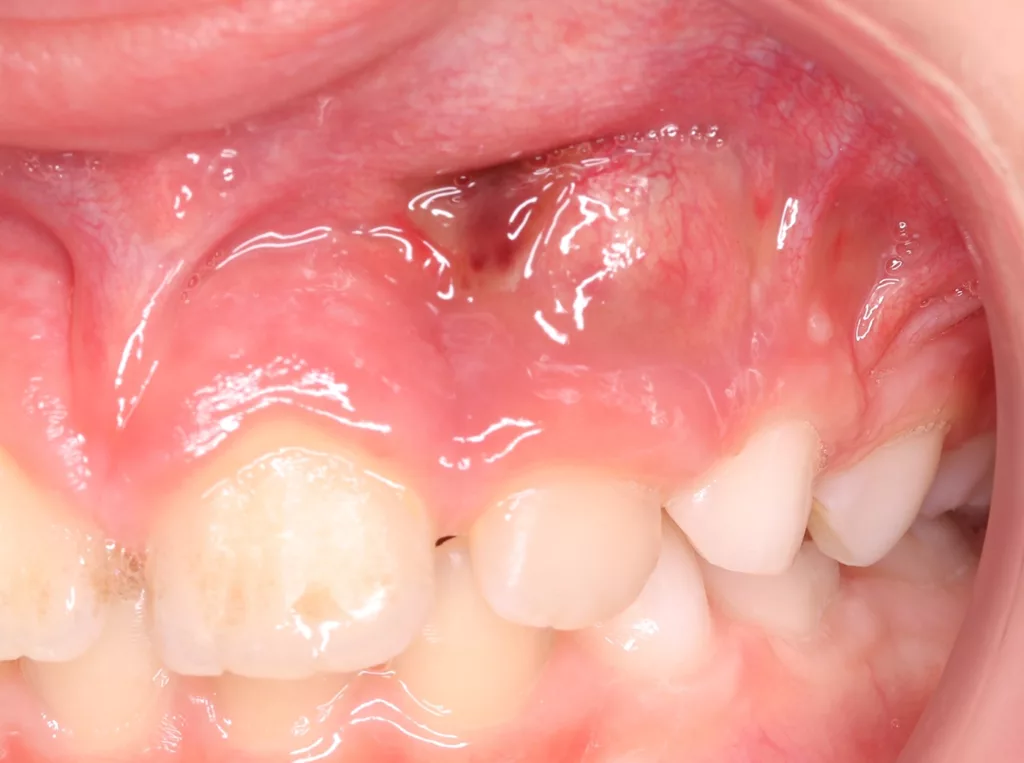
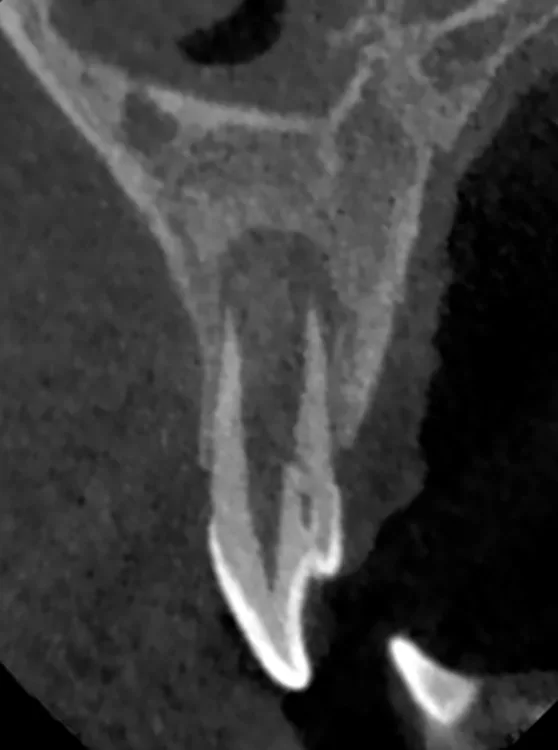
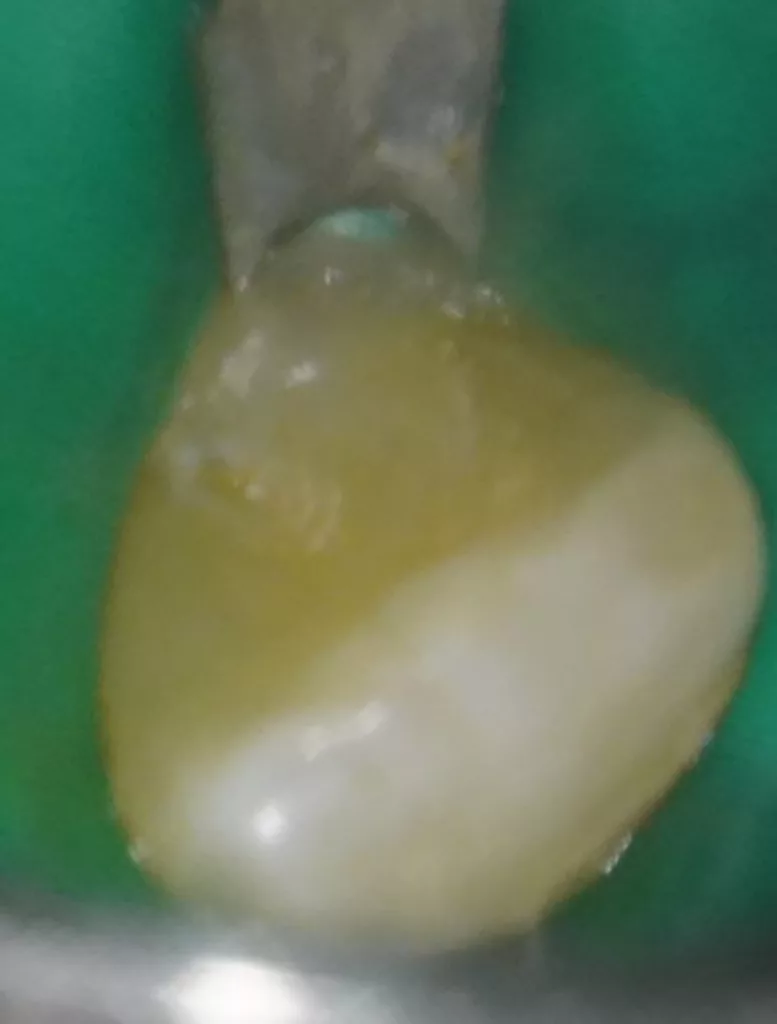
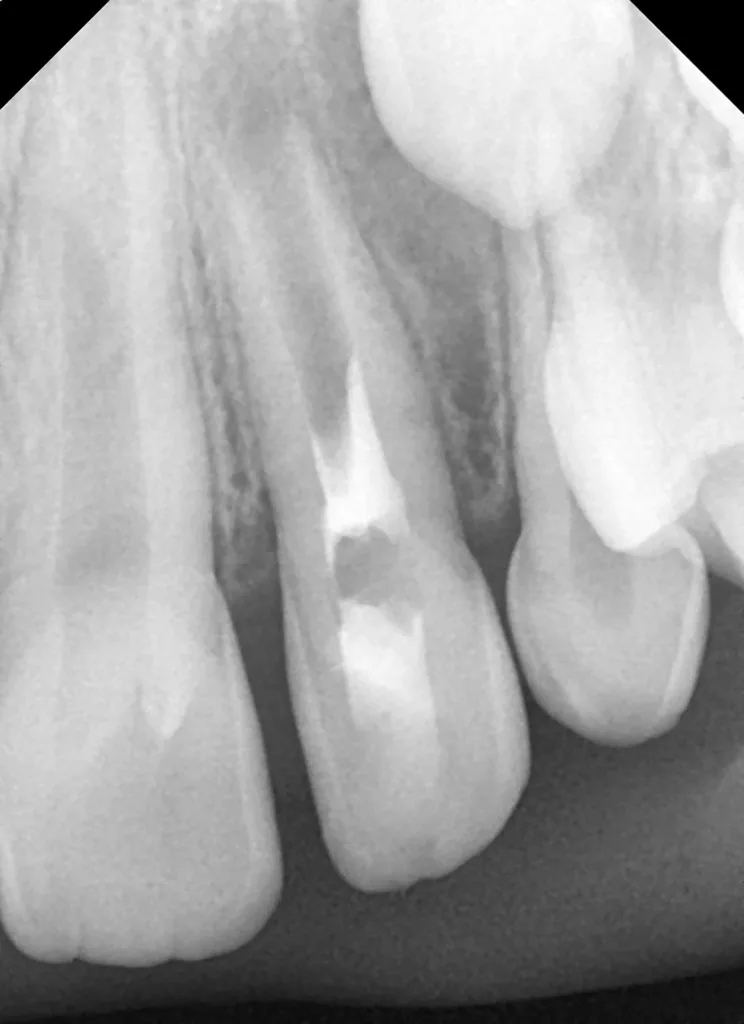
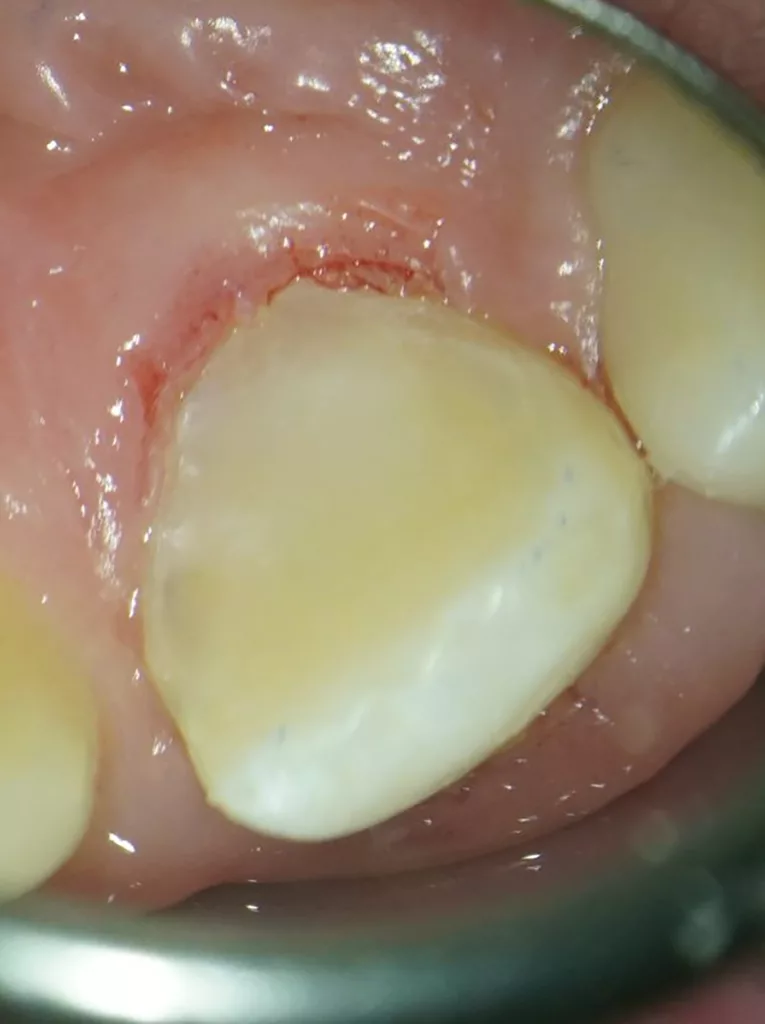
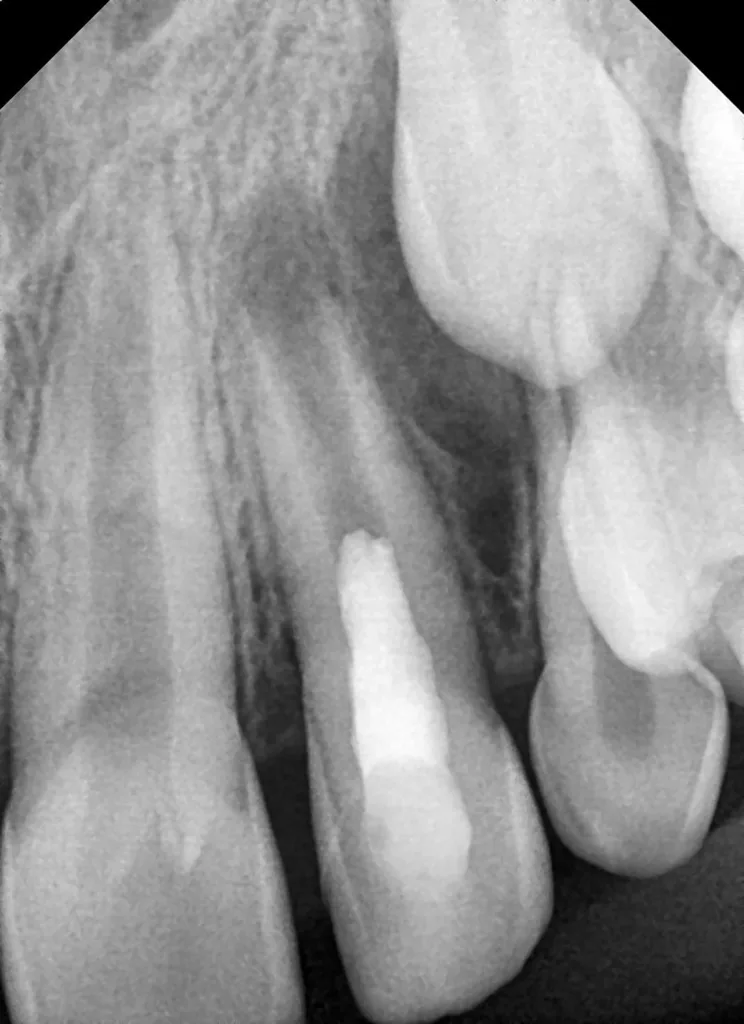
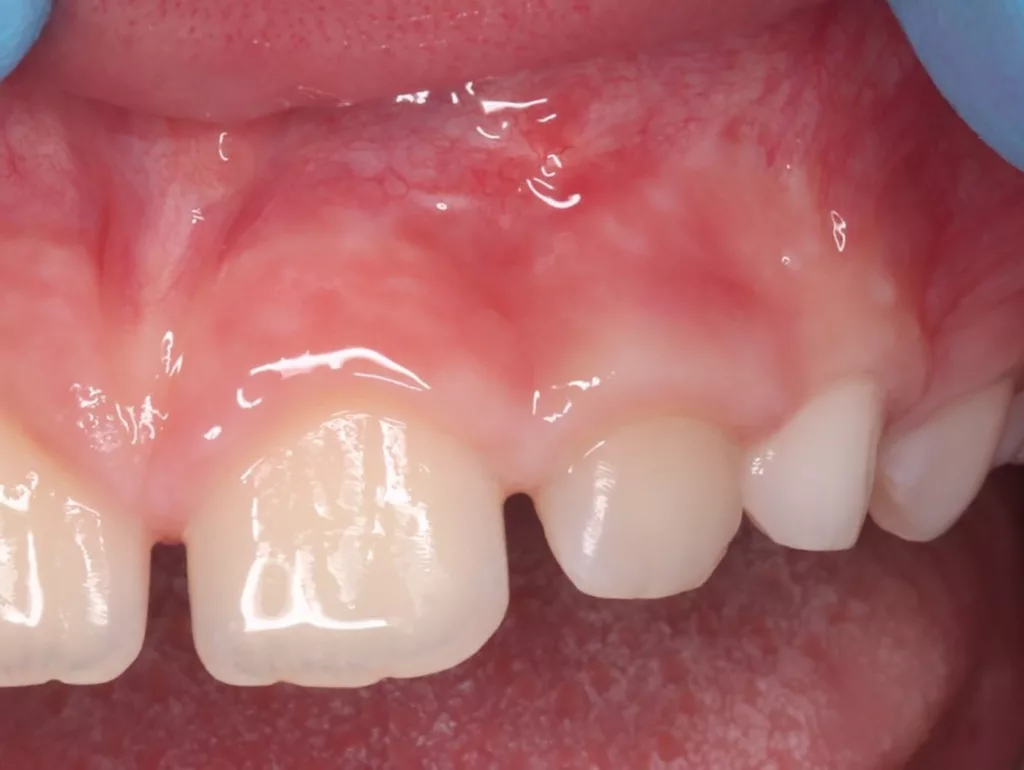
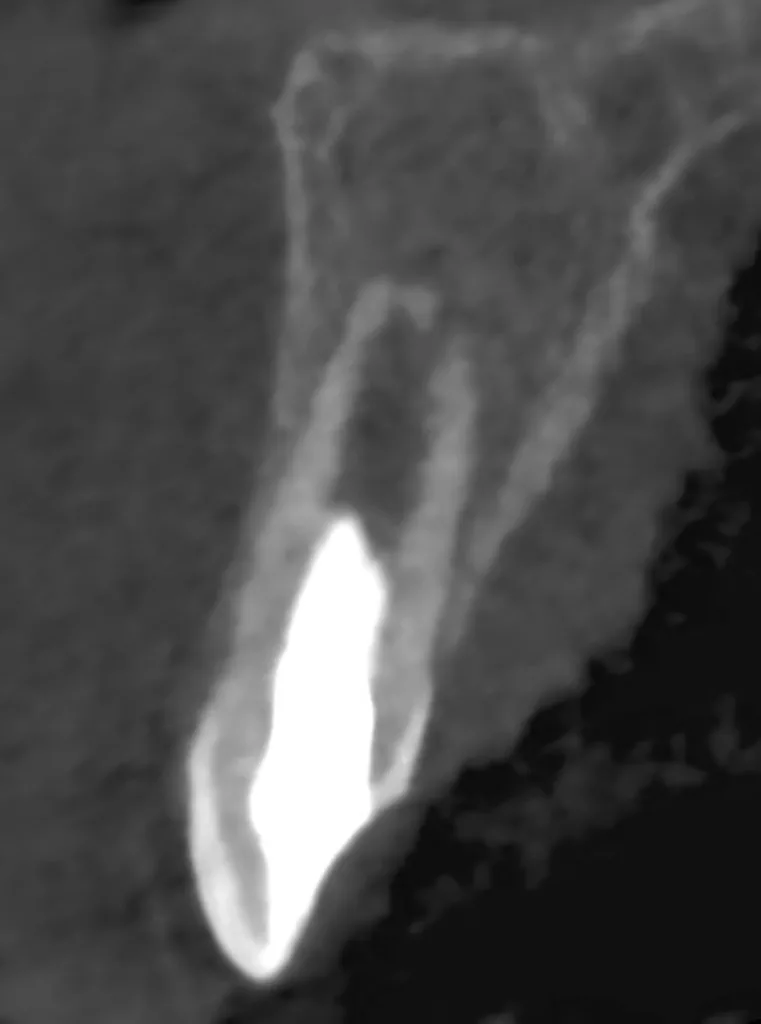
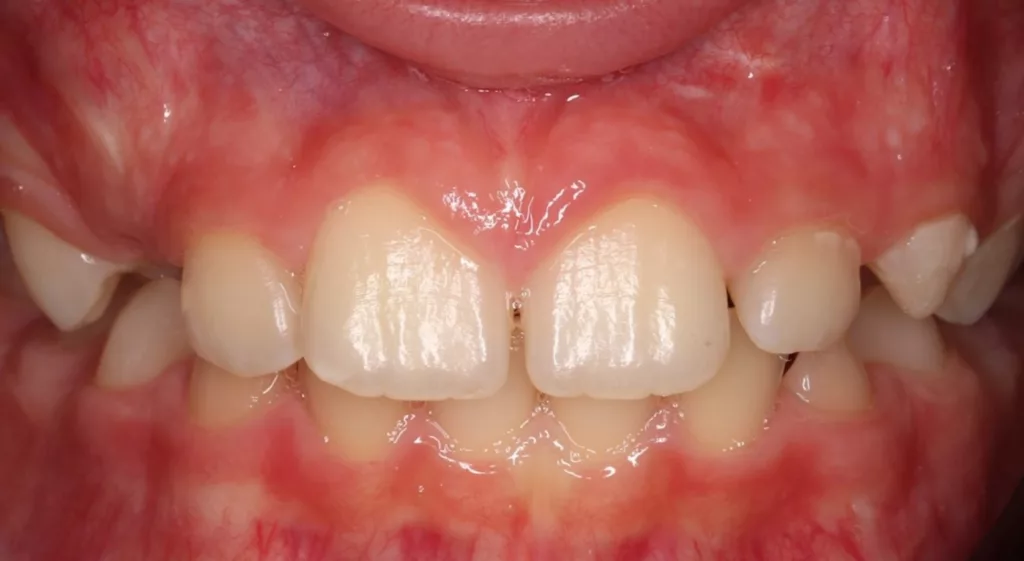
Der 8-jährige Junge wurde vom Kieferchirurgen zur Wurzelkanalbehandlung des symptomatischen Zahnes 22 mit periapikalem Abszess überwiesen (Abb. 1). Er gab an, seit zwei Tagen akute Schmerzen zu haben. Die Einnahme von Ibuprofen 40 mg/ml Kindersirup zeigte keine Wirkung. Der Kieferchirurg inzidierte den Abszess und verordnete für fünf Tage ein Antibiotikum. Der Zahn 22 sah klinisch intakt aus (Abb. 1 und 3), und die Anamnese ergab keinen Hinweis auf ein vorangegangenes Trauma. Aufgrund der unklaren Befundlage bestand die rechtfertigende Indikation für eine DVT-Aufnahme. Diese zeigte einen Dens invaginatus
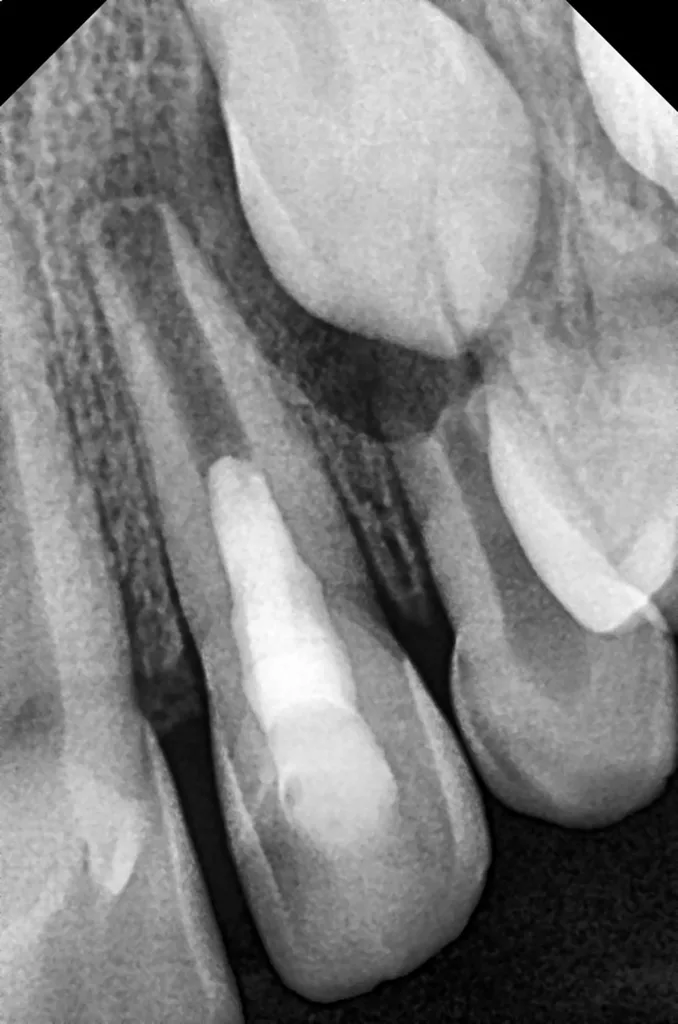
(Typ II nach Oehlers [22]) (Abb. 2 und 4). Eine Verbindung zwischen dem Wurzelkanal und der Invagination konnte in der DVT-Aufnahme bestätigt werden. Die Wurzel war im dritten Stadium der Wurzelentwicklung nach Cvek [53] (Abb. 2). Der Perkussionstest des Zahnes 22 ergab einen positiven Befund, der Sensibilitätstest fiel negativ aus. Anhand der erhobenen Befunde wurden die folgenden Diagnosen gestellt: Abszess mit Pulpanekrose und Parodontitis apicalis an Zahn 22 sowie Dens invaginatus, Typ II nach Oehlers.
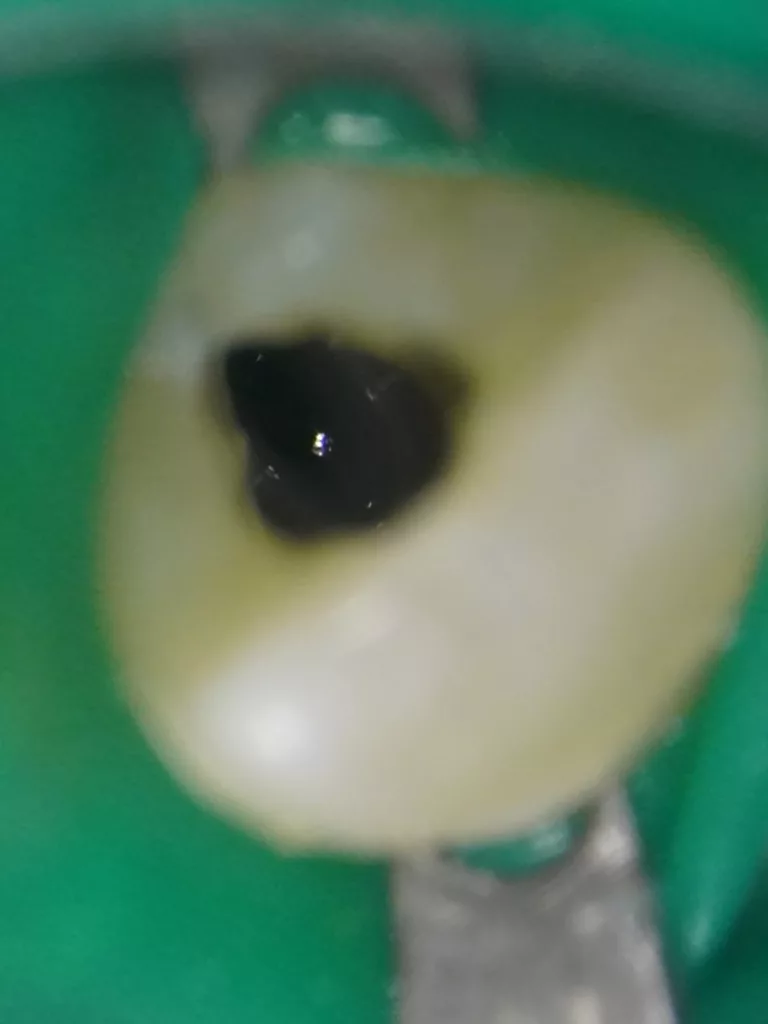
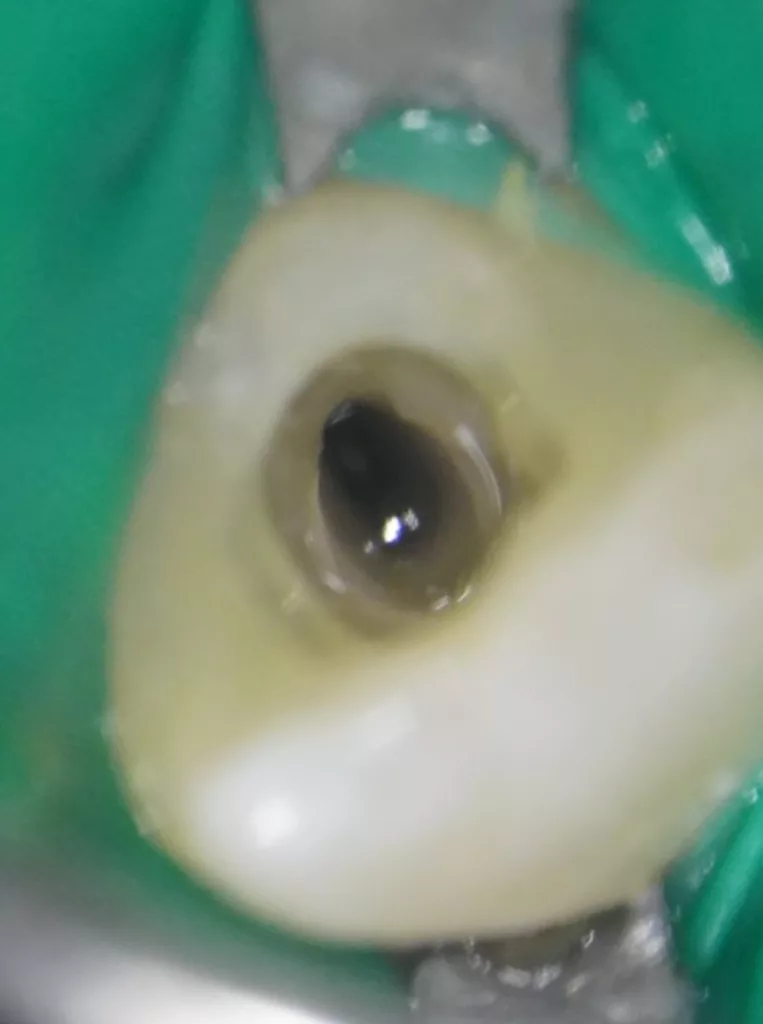
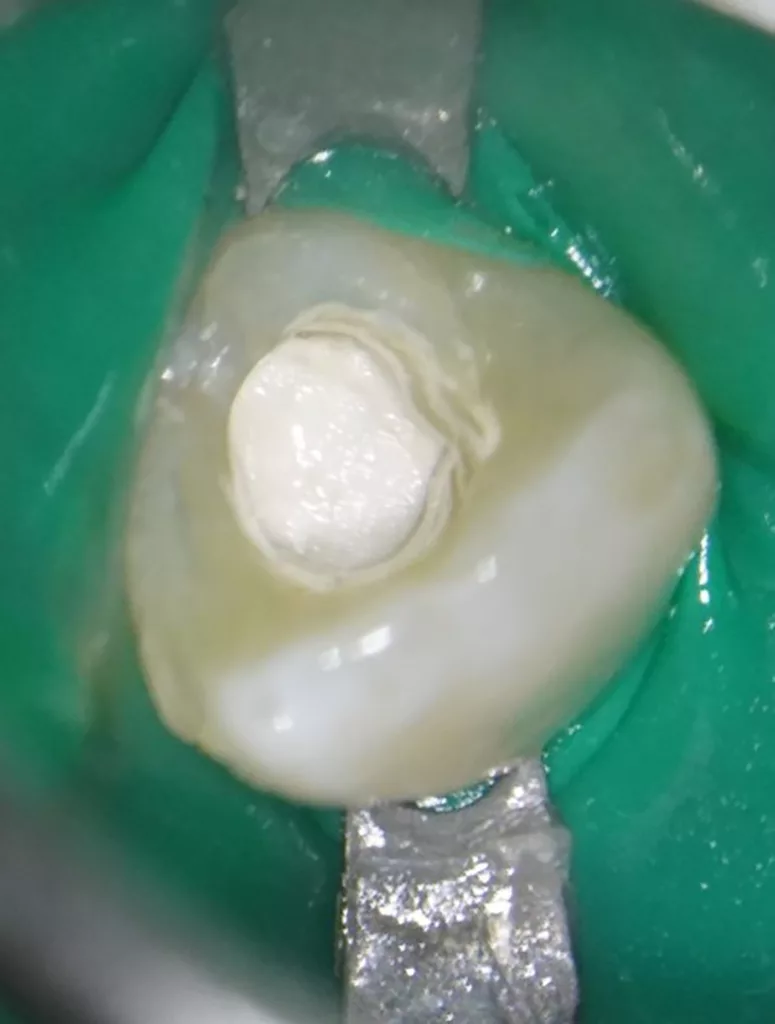
In der ersten Sitzung wurden die Schneidezähne mit dem Bürstchen gereinigt und nach Lokalanästhesie mit Septanest 1/200 000 (Septodont, Frankreich) und dem STA-System (Milstone Scientific, USA) konnte der Zahn 22 mithilfe von Kofferdam (Hygenic Brinker Clamp B5, Coltene/Whaledent AG, Schweiz) gut isoliert werden (Abb. 5). Bei der Präparation des Kanalzugangs wurde die Invagination mit dem Pulpenkavum verbunden, um keine versteckten infizierten Unterschnitte zu belassen und eine gute Visualisierung des Wurzelkanals zu erreichen (Abb. 6). Intrakoronal konnte kein Pulpagewebe gefunden werden, der Kanal war mit Pus gefüllt. Es erfolgte keine mechanische Bearbeitung des Wurzelkanals, lediglich eine Reinigung über eine Spülung mit 1,5%igem Natriumhypochlorid (20 ml für 5 Min.) unter Ultraschallaktivation (25 U-File, Mani, Japan).
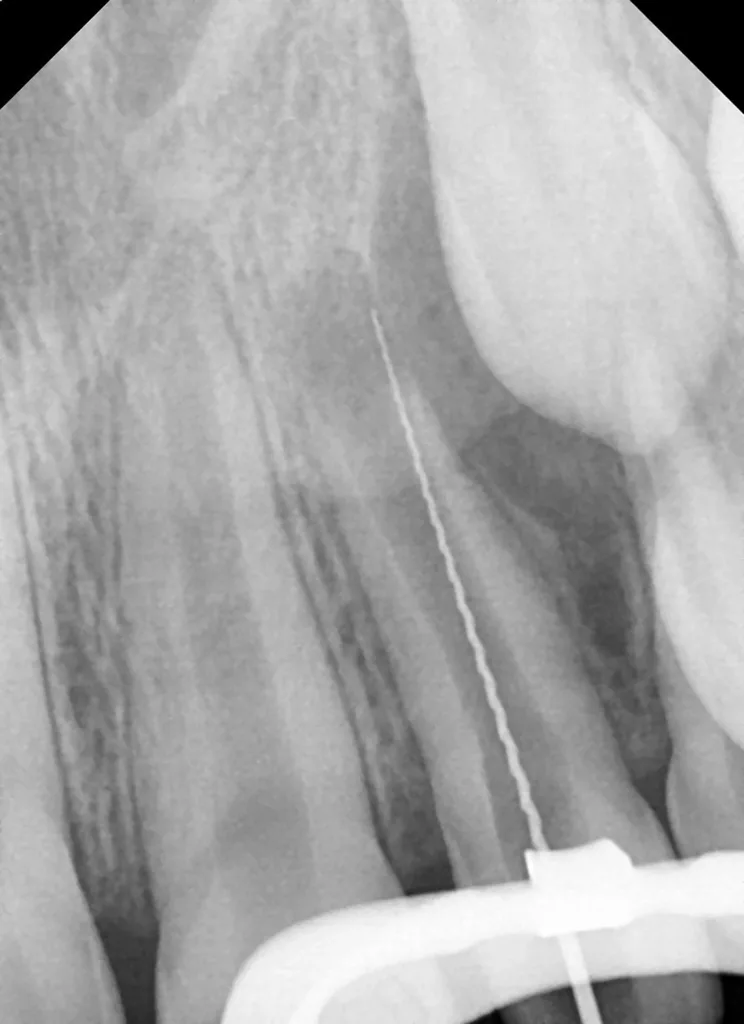
Die Aufbereitungslänge wurde über die DVT-Aufnahme ausgemessen, da die elektrometrische Längenbestimmung bei so unreifen Wurzeln nicht präzise genug ist. Die Spülkanüle wurde 2 mm kürzer als die Arbeitslänge eingestellt, um eine NaOCl-Extrusion über den Apex hinaus zu vermeiden. Nach einer finalen, ausgiebigen Spülung mit 17%iger EDTA- (20 ml für 5 Min.) und Kochsalzlösung (5 ml für 2 Min.) wurde der Wurzelkanal mit Papierspitzen getrocknet und eine medikamentöse Kalziumhydroxideinlage (UltraCal XS, Ultradent, USA) bis zur Hälfte des Kanals eingebracht. Abschließend erfolgte ein temporärer adhäsiver Verschluss (Abb. 7). Die Platzierung der Kalziumhydroxidpaste wurde mittels der neuangefertigten Röntgenaufnahme kontrolliert (Abb. 8).
Nach zwei Wochen war der Patient vollkommen beschwerdefrei. Es war keine Schwellung im Vestibulum mehr zu erkennen, die Inzisionswunde war verheilt und Perkussion sowie Palpation verliefen negativ. In der zweiten Sitzung erfolgte zuerst die Anästhesie ohne Vasokonstriktor mit Scandonest (Septodont, Frankreich) und dem STA-System (Milstone Scientific, USA), um die Einblutung in den Kanal zu erleichtern. Unter erneuter Trockenlegung mit Kofferdam wurde der temporäre Verschluss entfernt und der Kanal lediglich mit 17%iger EDTA- (20 ml für 5 Min.) und Kochsalzlösung (5 ml für 2 Min.) gespült (Abb. 9) und getrocknet. Um eine Blutung in den Wurzelkanal zu induzieren, wurde der Kanal periapikal mit der Hedström-Feile ISO 15 überinstrumentiert (Abb. 10 und 11).
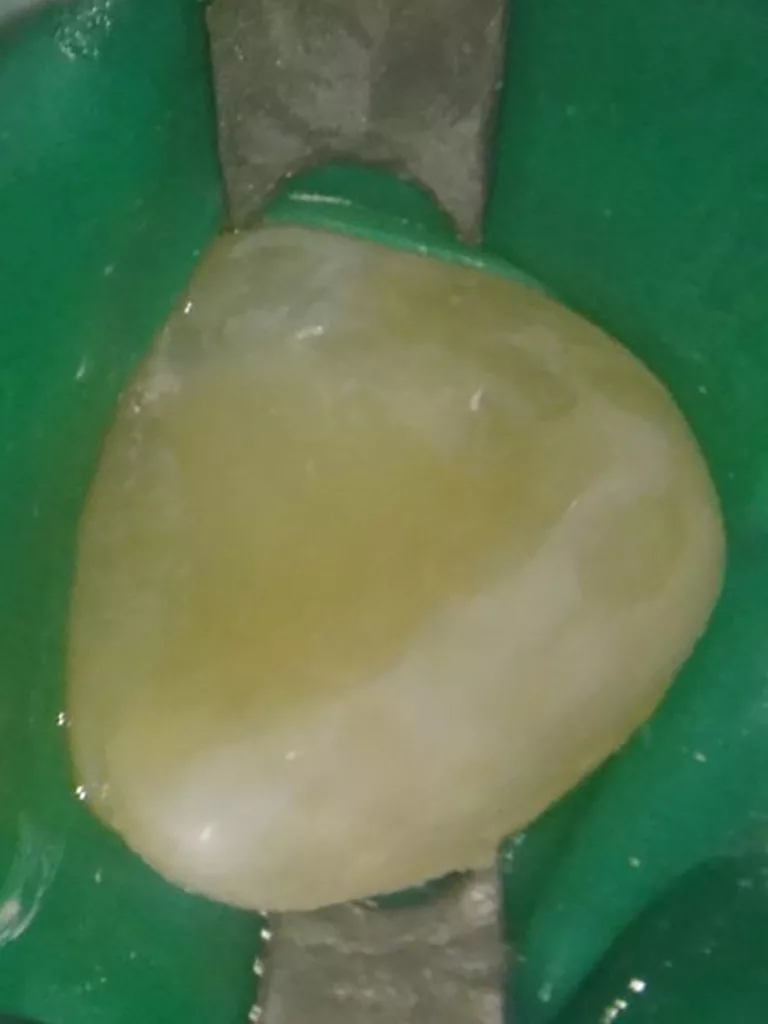
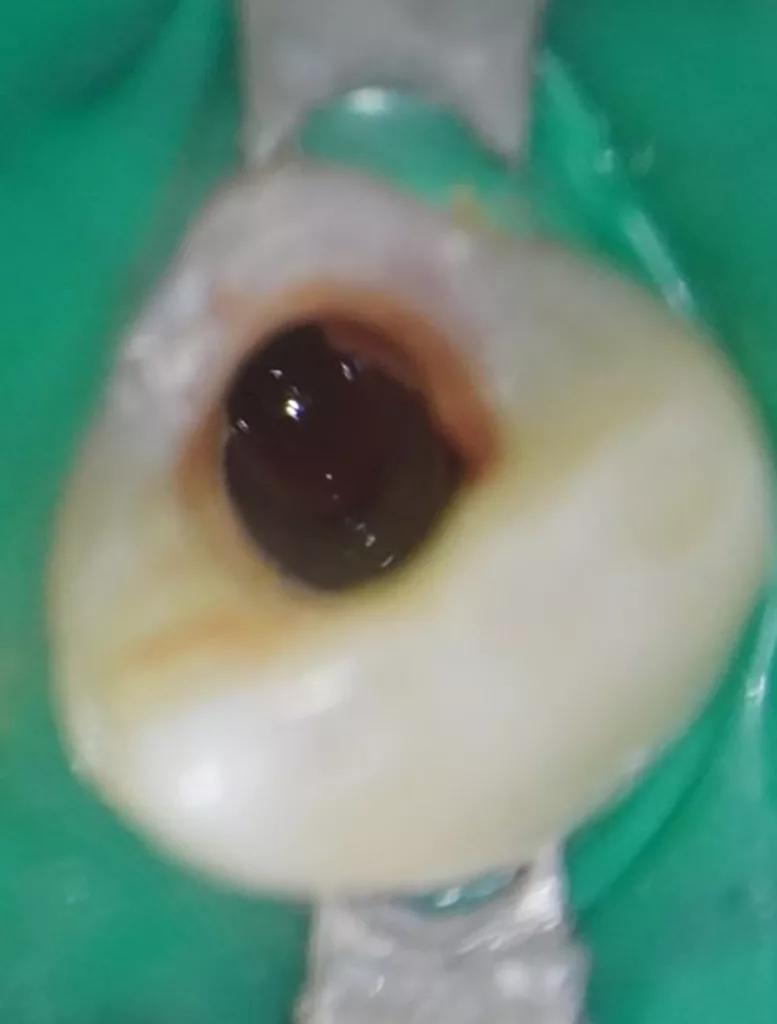
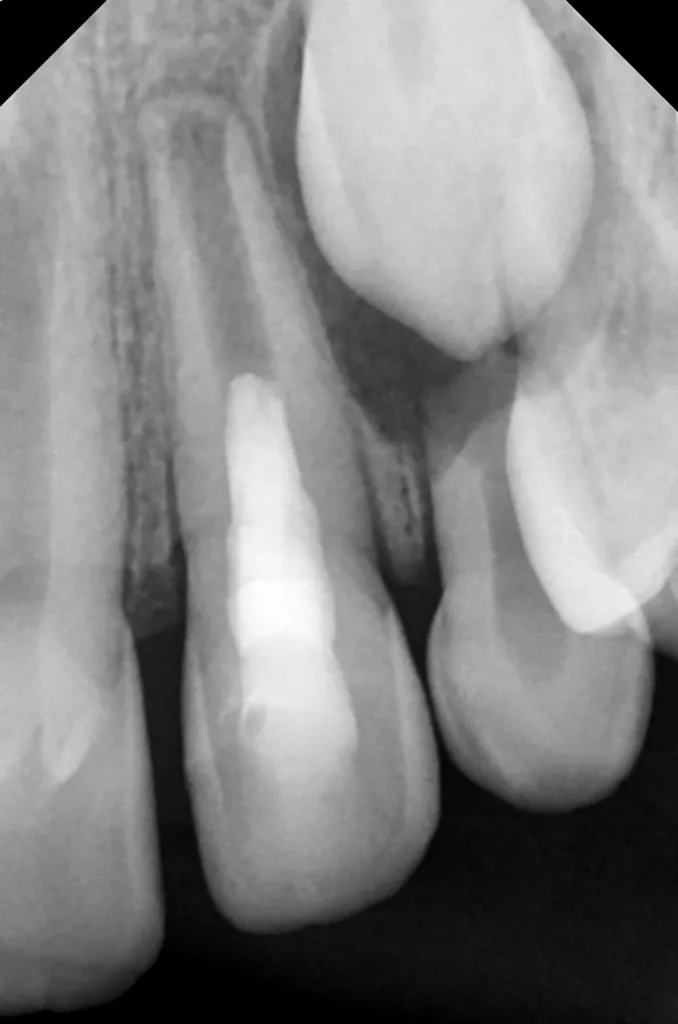
Eine Kollagenmatrix (SURGISPON, Aegis Lifesciences Pvt Ltd) kam zur Stabilisierung des Koagels zur Anwendung (Abb. 12). Dieses wurde mit einem hydraulischen Kalziumsilikatzement (Bio MTA+, Cerkamed) bis zur Höhe der Schmelz-Zement-Grenze abgedeckt (Abb. 13). Nach adhäsiver Vorbehandlung mit Optibond FL (Kerr, USA) konnte die endodontische Zugangskavität mit Komposit (Estelite Universal Flow AO2 und Estelite Asteria A2B (Tokuyama, Japan) verschlossen werden (Abb. 14). Abschließend wurde eine weitere Röntgenkontrollaufnahme angefertigt, um die Positionierung des hydraulischen Kalziumsilikatzements zu überprüfen (Abb. 15).
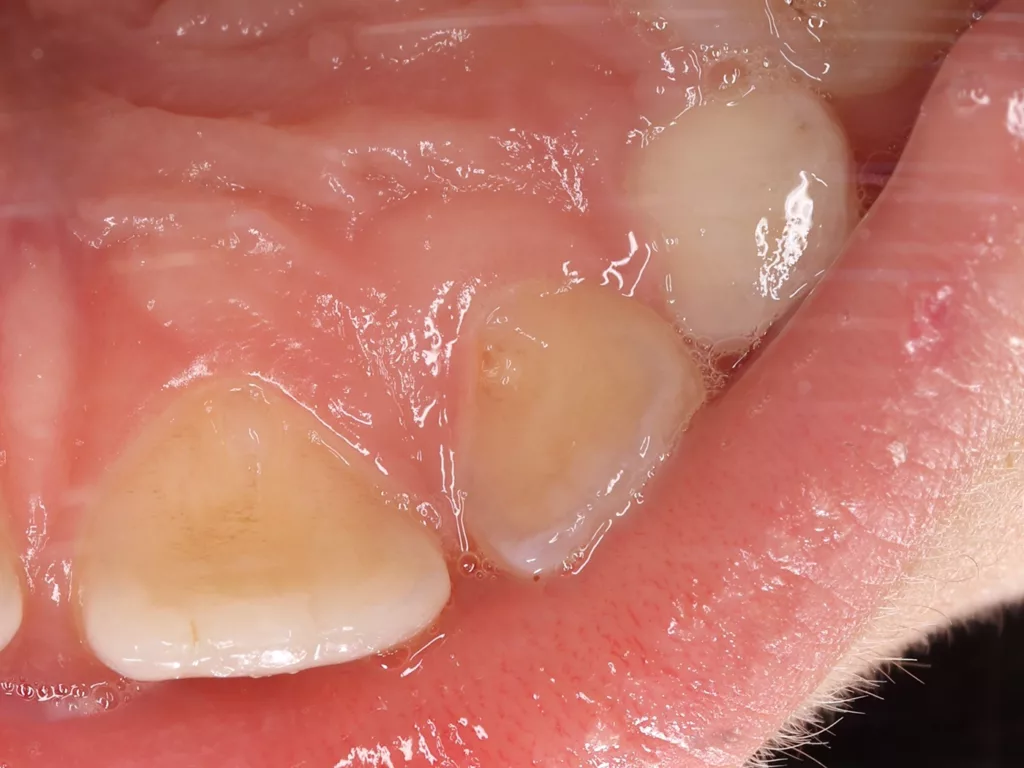
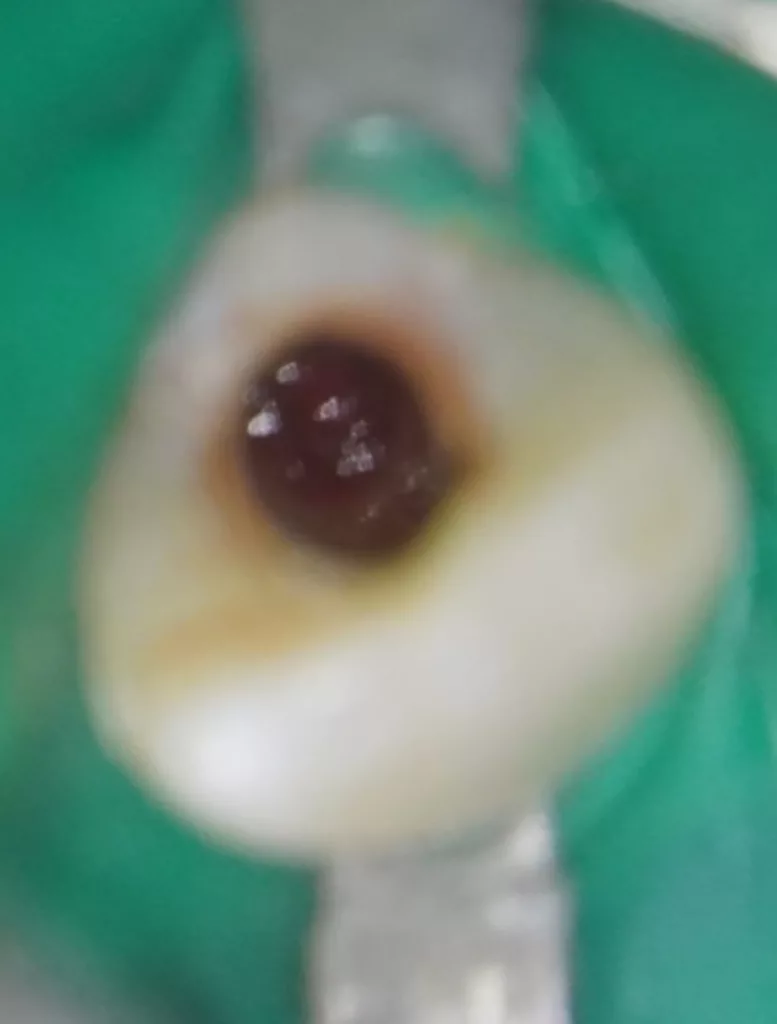
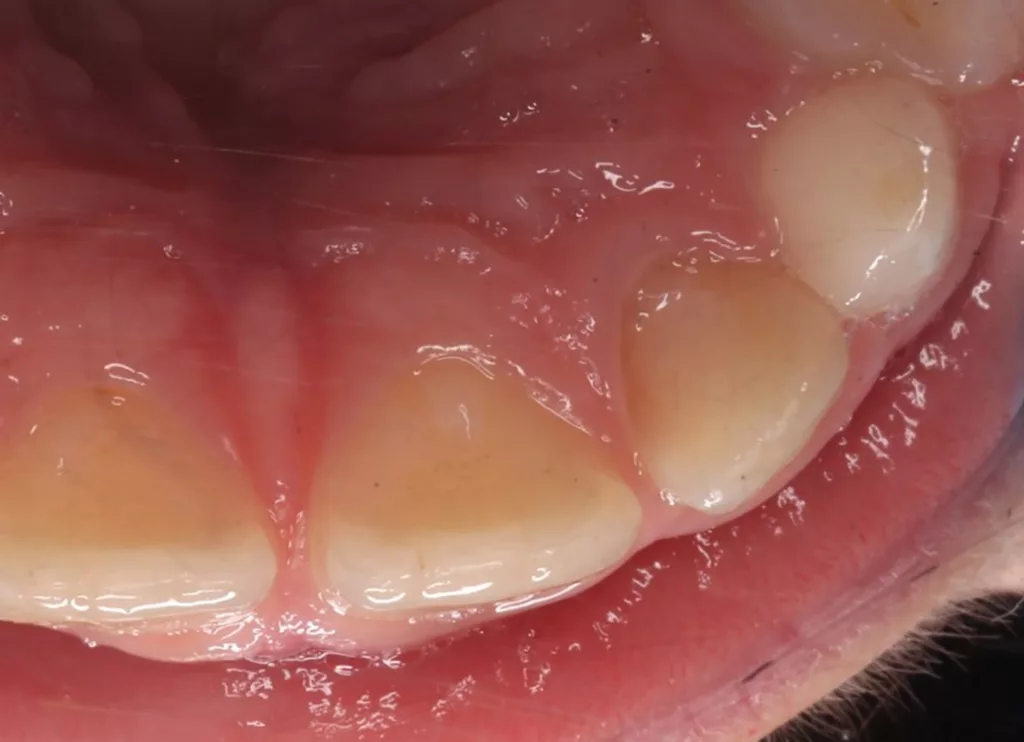
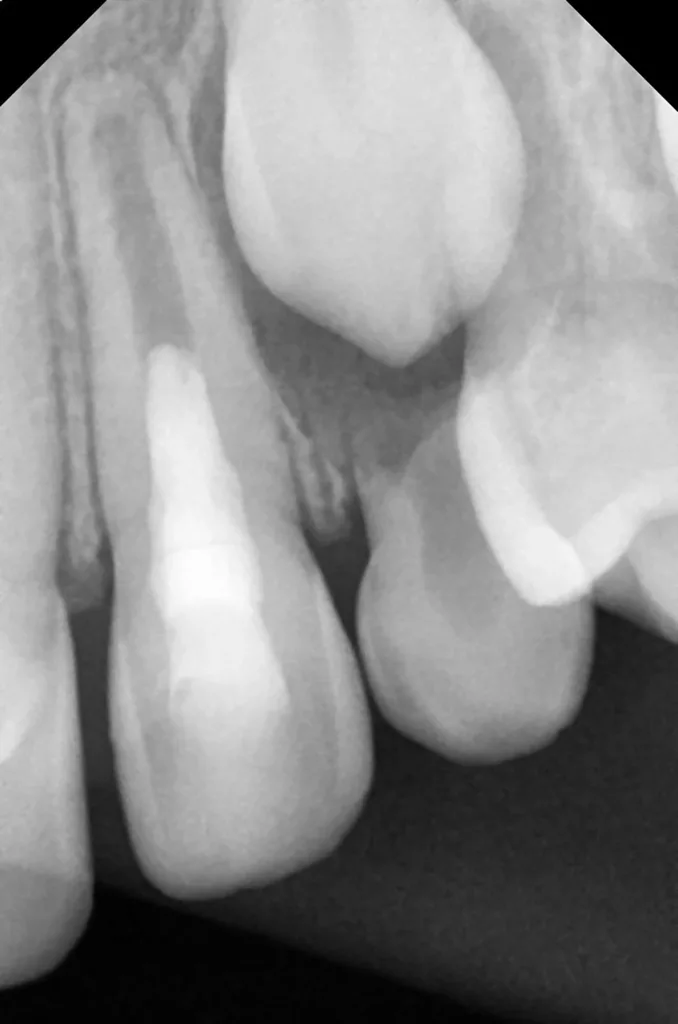
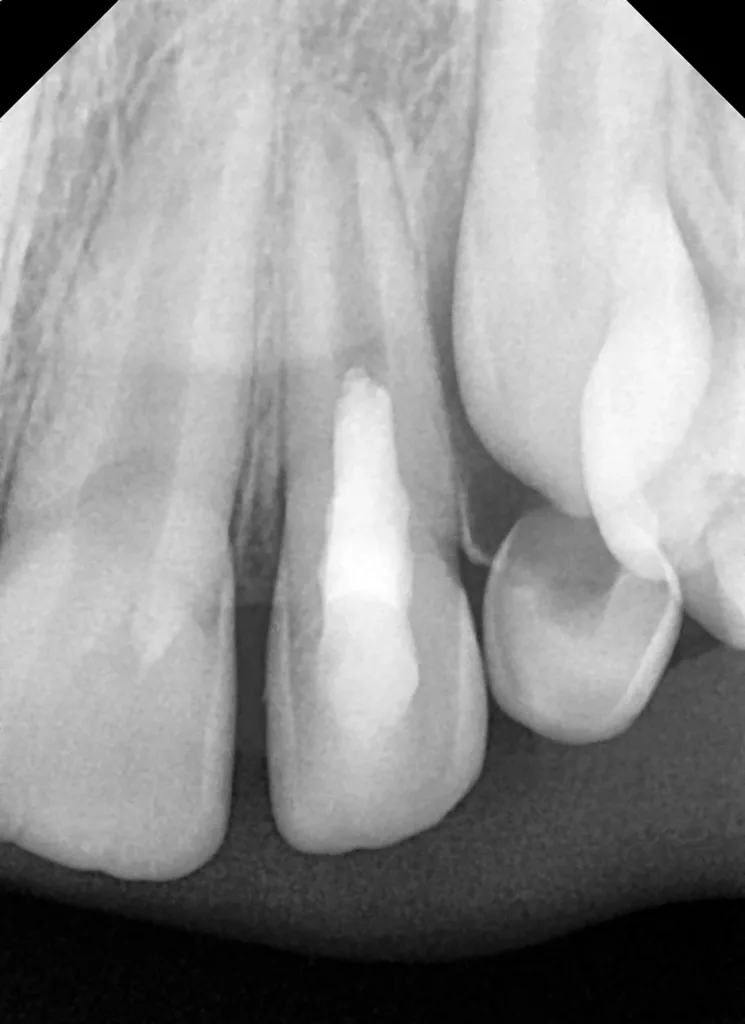
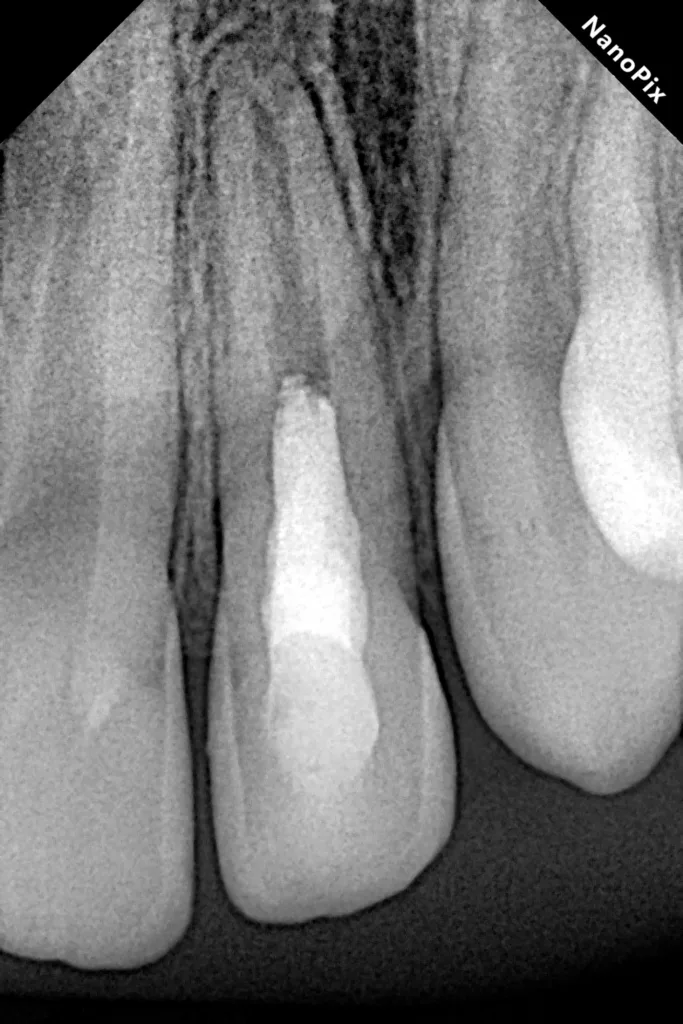
Nach zwei Monaten stellte sich der Patient beschwerdefrei zur Kontrolle vor. Der Zahn und das Zahnfleisch waren klinisch unauffällig, und Perkussion sowie Palpation verliefen negativ (Abb. 16 und 17). Röntgenologisch imponierte eine deutliche Verringerung der apikalen Aufhellung, und es war bereits auch die Entstehung einer apikalen Hartgewebsbarriere zu erkennen (Abb. 18). Weitere Röntgenbilder, die während eines 24-monatigen Beobachtungszeitraumes angefertigt wurden, zeigten eine komplette Heilung der Parodontitis apicalis, eine beträchtliche Dickenzunahme der Wurzelwände sowie ein Wachstum des Wurzelapex (Abb. 19 bis 23). Auch nach 24 Monaten waren keine Zahnverfärbungen zu sehen (Abb. 24).
Diskussion
Ursache für die Pulpanekrose und Abszessbildung war im vorliegenden Fall eine seltene Zahnanomalie, bei der es zu einer Einstülpung des Foramen caecum – dem sogenannten Dens invaginatus – während der Zahnentwicklung kommt. Die systematische Übersichtsarbeit und Metaanalyse von 2023 zeigt eine Prävalenz eines Dens invaginatus von 7,5%, wobei die seitlichen Schneidezähne mit einer Prävalenz von 5,1% am stärksten betroffen waren [21]. Der Dens invaginatus kann nach einer Klassifikation von Oehlers in drei Typen eingeteilt werden [22]:
- Typ I: Die Invagination reicht innerhalb der Zahnkrone bis zur Schmelz-Zement-Grenze und ist von Schmelz ausgekleidet. Es ist die häufigste Läsion mit einer Inzidenz von 79%.
- Typ II: Die Invagination reicht apikalwärts über die Schmelz-Zement-Grenze hinaus. Eine Verformung der Krone oder Wurzel und eine Verbindung zur Pulpa sind möglich.
- Typ III: Die Invagination besitzt apikal oder lateral eine direkte Verbindung zum Parodont und bildet so ein „zweites Foramen“ [22,23].
Obwohl bei einem Dens invaginatus des Typs II die Pulpa ziemlich schnell nach dem Durchbruch infiziert werden könnte, findet sich ein Dens invaginatus in nur 2% der in der Literatur beschriebenen Fälle, die mit einer RET behandelt worden sind [6]. In der regenerativen Literatur wird ein Zahntrauma als Ätiologie für Pulpanekrose in etwa 50% der Fälle genannt, wobei hier ein Dens evaginatus (eine andere, seltene Zahnfehlbildung, die sich in zusätzlichen höckerähnlichen Hartsubstanzausstülpungen manifestiert) mit 23% die am häufigsten auftretende Zahnanomalie ist, die eine RET erforderte [6]. Insgesamt können Patienten/-innen mit avitalen bleibenden Zähnen umso mehr von einer Revitalisierung als von einer Apexifikation profitieren, je weniger fortgeschritten das Wurzelwachstum ist [18].
Bei einer guten Patientencompliance sollte die Revitalisierung favorisiert werden, insbesondere in den Stadien I bis III der Wurzelentwicklung nach Cvek [17,18]. In diesen Stadien überwiegt der Vorteil einer weiteren Wurzelmaturation gegenüber der tendenziell höheren Komplikationsrate von Revitalisierungen im Vergleich zur Apexifikation [10]. Im Stadium IV der Wurzelentwicklung gelten sowohl Revitalisierung als auch apikaler Verschluss als gleichwertige Optionen [17,18]. Trotzdem ist die RET in bestimmten Fällen nicht anwendbar, wie zum Beispiel bei sofort wieder replantierten Zähnen nach Avulsion, bei Zähnen mit erheblichen Verlusten an koronalen Geweben, die eine Stift-Restauration erfordern, oder bei Zähnen mit endodontisch-parodontalen Läsionen [7].
Die Methode der regenerativen endodontischen Therapie ist relativ neu, wobei die grundlegende Idee in der Sterilisation der Pulpahöhle, der Stimulation von Stammzellen und anschließendem Aufbau einer Matrix für die Geweberegeneration besteht. Es gibt zahlreiche Optionen für Irrigationslösungen, intrakanaläre medikamentöse Einlagen und „Gerüst“-Materialien. (Der hier verwendete Begriff „Gerüst“ wird in der englischsprachigen Literatur als „Scaffold“ bezeichnet.) Die Stammzellen der apikalen Papilla (SCAP) gelten als Hauptquelle der Zellen für die Pulparegeneration. Demzufolge sollte daher ein geeignetes Spülprotokoll zur Anwendung kommen, um einerseits eine hohe Überlebensrate des SCAP und anderseits eine gute Reinigung und Desinfektion zu gewährleisten [1].
NaOCl ist das bevorzugte Irrigationsmittel in den meisten Studien zur RET aufgrund seines breiten antibakteriellen Spektrums und seiner Gewebelösungseigenschaften. Generell wurde NaOCl in Konzentrationen von 1 bis 6% in RET-Fällen erfolgreich eingesetzt. Dennoch zeigten mehrere Studien, dass NaOCl einen konzentrationsabhängigen Effekt auf das Überleben von SCAPs hatte [7]. Daher wird eine niedrige Konzentration von NaOCl in der RET empfohlen. Andererseits hat sich 17%ige EDTA-Lösung als wirksam erwiesen, um die schädlichen Nebenwirkungen von NaOCl auf die Anhaftung, das Überleben und die Differenzierung von Stammzellen zu mildern und die Freisetzung von endogenen Wachstumsfaktoren aus dem Dentin zu fördern [6,7].
Basierend auf diesen Erkenntnissen empfehlen die Richtlinien der AAE und ESE die Verwendung von 1,5%- bis 3%igem NaOCl, gefolgt von 17%iger EDTA-Lösung im ersten und zweiten Termin der RET [8,9]. Um die Effizienz der Desinfektion in den Wurzelkanälen zu verbessern, können Spülungsmethoden wie die „negative pressure irrigation“ (NPI), die passive Ultraschallspülung (PUI) oder ein mit einem Er:YAG-Laser aktiviertes Spülprotokoll (photon-induced photoacoustic streaming“, PIPS) eingesetzt werden [7]. Bemerkenswerterweise wird Chlorhexidin für die RET nicht empfohlen, da es keine Gewebelösungsfähigkeit besitzt und als zytotoxisch für Stammzellen angesehen werden muss [24].
Obwohl es mehrere Fallberichte gibt, in denen die RET mit nur einer Sitzung ohne die Verwendung einer medikamentösen Einlage erfolgreich war [25–28], ist es nicht bekannt, ob 1,5% Natriumhypochlorit in der Lage ist, Bakterien in Biofilmen im infizierten Wurzelkanalsystem vollständig effektiv abzutöten [17]. Deswegen erfordert das Protokoll der RET laut der American Association of Endodontists (AAE) und der European Society of Endodontology (ESE) in der Regel mindestens zwei Sitzungen, um durch die medikamentöse Einlage eine vollständige Desinfektion des Wurzelkanalsystems zu ermöglichen [8,9]. Ursprünglich wurde dafür Tri-Antibiotikapaste (TAP) mit Ciprofloxacin 250 mg, Metronidazol 500 mg und Minocyclin 500 mg in einer Macrogol/Propylenglykol-Mischung verwendet [5]. Obwohl die Tri-Antibiotikapaste in 51 bis 80% der RET-Fälle eingesetzt wurde und sich als wirksam bei der Desinfektion nekrotischer Wurzelkanalsysteme erwies, gibt es einige Nachteile [7]: Es wurde in vitro gezeigt, dass hohe Konzentrationen (10 bis 100 mg /ml) von TAP schädlich für das Überleben von SCAPs sind.
Die AAE empfiehlt deswegen eine Konzentration von 0,1 bis 1 mg /ml TAP in der RET, um Schäden an SCAPs zu vermeiden [8]. Auf diese Weise ist die TAP-Zubereitung ziemlich kompliziert und erfordert vonseiten der Zahnärzte/-innen einiges an pharmakologischem Fachwissen [2]. Es ist auch zu beachten, dass TAP aufgrund des Minocyclingehalts zu Zahnverfärbungen führen kann. Alternativen wie DAP ohne Minocyclin oder der Austausch von Minocyclin durch andere Antibiotika wie Clindamycin oder Cefaclor oder Verwendung nur eines Antibiotikums (Augmentin) sind möglich [17,29,30]. Trotzdem besagt die Stellungnahme der ESE zur Verwendung von Antibiotika in der Endodontie, dass aufgrund der fehlenden Evidenz zur Nutzung der antibiotischen Einlagen deren Einsatz in regenerativen endodontischen Verfahren vermieden werden sollte [31].
Eine Alternative zum Antibiotikum als medikamentöse Einlage ist Kalziumhydroxid. Obwohl es eine geringere antibakterielle Wirksamkeit als TAP aufweist [32,33], bietet es mehrere Vorteile, darunter keine Verfärbung, geringere Zytotoxizität gegenüber Stammzellen, bessere Überlebensraten und Proliferation von Stammzellen auf dem behandelten Dentin sowie eine verstärkte Freisetzung von Wachstumsfaktoren aus dem Dentin [7]. Angesichts der oben genannten vorteilhaften Effekte hat die ESE Ca(OH)₂ als bevorzugtes Intra-Medikament in der RET empfohlen [9].
Die Metaanalyse von Baez et al. verglich die Ergebnisse von RET mit Antibiotikapasten und Kalziumhydroxid [34]. Sie zeigte, dass die Verwendung von TAP einen höheren Anteil an Zunahme der Dicke der Wurzelkanalwand zur Folge hatte – 66% (CI95: 58–73%) im Vergleich zu Ca(OH)₂ – 53% (CI95: 26–78%). Andererseits führte Ca(OH)₂ zu einem höheren Prozentsatz an apikalem Verschluss – 88% (CI95: 80–93%) gegenüber 66% (CI95: 58–73%). Die Verlängerung der Wurzel wurde in 80% (CI95: 60–92%) der Fälle bei Kalziumhydroxid und in 68% (CI95: 60–74%) der Fälle bei Antibiotikapasten geschätzt [34]. Es wurde auch bei Bose et al. beobachtet, dass die Position von Ca(OH)₂ das Behandlungsergebnis beeinflusste, da bessere Ergebnisse erzielt wurden, wenn Ca(OH)₂ auf das mittlere Drittel der Wurzel beschränkt wurde, im Vergleich zu der Platzierung auf apikalem Niveau [35].
Während der RET besteht das Ziel in einer Induktion einer Blutung im Wurzelkanal, um dort ein Blutgerinnsel als Gerüst zu schaffen und Wachstumsfaktoren sowie Stammzellen aus der apikalen Region in den Wurzelkanal zu fördern, um die Geweberegeneration zu unterstützen. Das ist ein verhältnismäßig einfacher und direkter Ansatz [7]. Plättchenreiches Plasma (PRP), plättchenreiches Fibrin (PRF) oder konzentrierte Wachstumsfaktoren (CGF) können ebenfalls klinische Alternative zur Einblutung bei der RET sein, da sie reich an Wachstumsfaktoren sind, die wiederum helfen könnten, die Regeneration des Pulpa-Dentin-Komplexes zu verbessern [17].
Die systematische Übersicht von Pecci-Lloret et al. zeigte, dass die klinische Erfolgsrate für alle Arten von „Gerüsten“ ausgezeichnet war. Das Gerüst mit dem höchsten Prozentsatz an positiver Reaktion auf den Vitalitätstest, das das beste Wachstum der Dentinwände induziert und die Entwicklung des Wurzelwachstums förderte, war das plättchenreiche Plasma [36]. Verschiedene exogene Gerüste, einschließlich Kollagen Typ 1, Fibrin, Hydrogel und Kollagen-Hydroxyapatit, die in der Regel vorher mit Wachstumsfaktoren beladen wurden, sind ebenfalls klinisch in RETs verwendet worden [7]. In sogenanntem Zell-Homing-Ansatz spielen Signalmoleküle eine große Rolle, da sie einen chemotaktischen Effekt auf Stammzellen von der apikalen Papille ausüben können, die dann in den Wurzelkanal einwandern und dort differenzieren [20].
Eine gute Quelle dieser Signalmoleküle könnte das Dentin sein. In der Dentinmatrix befinden sich über 800 verschiedene Proteine, darunter 54 Signalmoleküle wie Zytokine, das knochenspezifische morphogenetische Protein, Transforming Growth Factor-Beta (TGF-β1) und der fibroblastische Wachstumsfaktor 2 (FGF2) [17,18,20]. In der Klinik konnte es in folgenden Verlauf implementiert werden: Nach Desinfektion des Wurzelkanals wird mehrmals ultraschallaktiviert mit EDTA gespült, die Lösung wird aus dem Wurzelkanal entnommen, die Dentinmatrixproteine durch Zentrifugation aufkonzentriert und anschließend mit einem Trägermaterial vermischt und in den Kanal zurückgegeben [18,20,37,38].
Ein weiterer Schritt, der bisher nur auf der Forschungsebene geblieben ist, könnte die Zelltransplantation sein, bei der ein Gerüstmaterial sowohl mit Signalmolekülen als auch mit Stammzellen besetzt ist [20,39]. Derzeit gibt es fünf Haupttypen von Zahn-Stammzellen (DSCs): Zahnpulpa-Stammzellen (DPSCs), Stammzellen aus exfolierten Milchzähnen (SHED), Stammzellen aus der apikalen Papille (SCAP), parodontale Ligament-Stammzellen (PDLSCs) und dentale Follikel-Vorläuferzellen (DFPCs) [39,40]. Nakashima et al. haben erfolgreich fünf Patienten mit irreversibler Pulpitis mittels MDPSCs-Transplantation behandelt [41].
Trotzdem ist die Umsetzung dieser Anwendung in der zahnärztlichen Praxis noch schwierig [20]. Dennoch ist das Thema heute ein großes Forschungsgebiet; leider fehlt es noch an Evidenz, dass PRP oder andere Gerüste die Regeneration des Pulpa-Dentin-Komplexes verbessern könnten. Insgesamt wird die induzierte Blutung häufiger als ein Gerüst bei der RET eines nicht vitalen, unreifen, bleibenden Zahns empfohlen [8,9,42]. Das verwendete Gerüst wird am besten mit einem hydraulischen Kalziumsilikatzement, wie MTA oder Biodentin, verschlossen [8,9], da sich beide Materialien gut für die Vitalerhaltung der Zahnpulpa und für den apikalen Plug bewährt haben [43,44]. Um das Verfärbungsrisiko von MTA selbst oder nach Kontakt des Materials mit Blut zu vermeiden, sollten hydraulische Kalziumsilikatzemente unterhalb des Zement-Schmelz-Übergangs platziert werden [8,9].
Die Richtlinien der American Association of Endodontists für regenerative endodontische Verfahren definieren den Erfolg anhand von drei Kriterien:
- primäres Ziel (essenziell): Beseitigung der Symptome und Nachweis einer knöchernen Heilung
- sekundäres Ziel (wünschenswert): apikaler Verschluss sowie Zunahme der Wurzellänge und der Dentinstärke
- tertiäres Ziel: positive Reaktion auf den Vitalitätstest [8,9]
Das primäre Ziel, die Auflösung der Anzeichen/Symptome einer Infektion und die Heilung des Knochens, ist in der Regel erreichbar [17]. Die letzten systematischen Übersichten zeigten, dass die Erfolgsrate für die Auflösung einer periapikalen Pathologie in 91% der Fälle mit RET zuverlässig erreicht wurde [12,17,45]. Sekundäre Ergebnisse wie eine weitere Wurzelentwicklung (80%) und eine apikale Verschlussbildung (76%) waren deutlich variabler [12,17,45].
Nach Chen et al. [46] können fünf verschiedene Typen der Gewebereaktion nach RET an permanenten Zähnen mit nicht abgeschlossenem Wurzelwachstum, nekrotischer Pulpa und apikaler Läsion beobachtet werden:
- Typ 1: apikaler Verschluss und Zunahme der Wurzellänge und der Dentinstärke
- Typ 2: stumpfe und geschlossene Wurzelspitze ohne Anzeichen von Wurzelentwicklung
- Typ 3: Fortsetzung der Wurzelentwicklung, aber ohne Schließung des apikalen Foramens
- Typ 4: gut erkennbare Mineralisationen im Wurzelkanalraum
- Typ 5: Bildung einer Hartgewebsbarriere im Wurzelkanal zwischen dem koronalen MTA-Plug und der Wurzelspitze [1,46]
In unserem Fall wurde der primär erwünschte Typ 1 einer Gewebereaktion als apikaler Verschluss beobachtet, der eine Zunahme der Wurzellänge sowie der Wurzeldentindicke beschreibt.
Diogenes et al. berichteten, dass das tertiäre Ziel der Rückkehr einer positiven Reaktion auf den Pulpasensibilitätstest nach RET von unreifen bleibenden Zähnen mit nekrotischer Pulpa in 50 bis 60% der veröffentlichten Fälle erreicht wurde [47]. Histologische Befunde eines menschlichen, unreifen bleibenden Zahnes mit apikaler Parodontitis nach RET zeigten ein zementartiges, knochenähnliches Gewebe, faseriges Bindegewebe und Nervenfasern im Kanal, jedoch nicht das Pulpagewebe, obwohl der Pulpasensibilitätstest positiv war [48].
Daher bedeutet eine positive Reaktion auf den Pulpasensibilitätstest von unreifen bleibenden Zähnen mit nekrotischer Pulpa nach RET nicht unbedingt eine Regeneration des Pulpagewebes [17]. Obwohl Schmoeckel et al. gute langfristige Ergebnisse von RET bis acht Jahre nach der Behandlung zeigten [1], gibt es nur wenige langfristige Studien für Ergebnisse von über zwei Jahren [12,13], sodass noch keine finale Prognose zur Erhaltung von Zähnen, die mit RET behandelt wurden, abgegeben werden kann.
Häufige Komplikationen im Zusammenhang mit RETs sind Schmerzreaktionen, Zahnverfärbungen und intrakanaläre Verkalkungen [1]. Zahnverfärbungen könnten theoretisch vermieden werden, indem folgende Empfehlungen befolgt werden:
- Auf die Verwendung von Minocyclin ist entweder zu verzichten, oder es sollte nur bis zur Höhe der Schmelz-Zement-Grenze nach dem Versiegeln der Pulpakammer mit einem Dentin-Bonding-Agent platziert werden.
- Verwendung einer resorbierbaren Matrix über dem Blutgerinnsel, die es von den Barrierematerialien trennt
- Verwendung eines hydraulischen Kalziumsilikatzements als Barrierematerial unterhalb der CEJ ohne Bismuthoxide, stattdessen mit Zirkoniumoxid [7]
Bei verfärbten Zähnen nach einer RET hat sich ein internes Bleaching als eine wenig invasive Behandlungsoption mit vorhersehbarem Ergebnis gezeigt [49,50]. Wenn das Ergebnis den ästhetischen Ansprüchen nicht genügen sollte, könnten sekundäre invasivere Interventionen, wie die Versorgung mit keramischen Restaurationen, immer noch in Erwägung gezogen werden [7].
Sekundäre intrakanaläre Kalzifikationen oder Obliterationen sind ebenfalls ein häufiges Problem bei Zähnen, die initial mit RETs behandelt wurden. Sie wurden von Song et al. als „revascularization-associated intracanal calcification“ (RAIC) definiert. RAIC wurde in 62,1% der Fälle einer RET festgestellt, wobei ein progressiver Verlauf der Kalzifikation im Laufe der Zeit beobachtet wurde [51]. Einige Studien weisen darauf hin, dass intrakanaläre Kalzifikationen nicht als pathologischer Zustand interpretiert werden sollten [52].
Trotzdem könnte eine übermäßige Kalzifikation weiterführende endodontische Behandlungen verkomplizieren, falls eine weitere Infektion auftritt, und ebenso die Lokalisation des Wurzelkanales erschweren. Bei Patienten/-innen, die nach RET unter RAIC leiden, ist eine weitere Behandlung in der Regel nicht notwendig, es sei denn, der Zahn weist klinische Symptome auf. Wenn behandlungsbedürftige Symptome auftreten, könnten eine Wurzelkanalbehandlung mit geführtem Zugang oder eine mikroendodontische Chirurgie weitere Behandlungsoptionen darstellen. Im schlimmsten Fall müsste sogar eine Zahnextraktion in Betracht gezogen werden, gefolgt von einer entsprechenden prothetischen Versorgung [7].
Fazit
Der dargestellte klinische Fall und der Literaturüberblick zeigen, dass die RET (regenerative endodontische Therapie) gemäß den Richtlinien der Europäischen Gesellschaft für Endodontologie ein relativ einfaches Verfahren darstellt, das eine Heilung der apikalen Parodontitis ermöglicht und weiteres Wurzelwachstum bei avitalen bleibenden Zähnen mit nicht abgeschlossenem Wurzelwachstum fördert. Die regenerative endodontische Therapie ist ein umfangreiches Forschungsgebiet, das weiterhin viel Potenzial für die Weiterentwicklung von Behandlungsmethoden des endodontologischen Behandlungsportfolios bietet und langfristig zum Zahnerhalt beitragen kann.
Sollte dieses Ziel letztendlich nicht erreicht werden können, gewinnt man über diese Therapieoption über einen langen Zeitraum immerhin wertvolle Zeit, da der Zahn als Platzhalter fungiert und zudem den Knochen in situ hält. Kommt es in späteren Jahren zu einem Verlust des Zahnes, ergeben sich bei dem dann (hoffentlich) ausgewachsenen Gebiss deutlich mehr und definitivere prothetische Versorgungsmöglichkeiten, als dies bei einem Kind oder Jugendlichen der Fall wäre. Somit sollte bei Bestehen der klinischen Voraussetzungen für eine regenerative endodontische Therapie diese Option immer in Erwägung gezogen werden – selbst wenn es sich nur um einen Behandlungsversuch mit unklarer Prognose handelt.
 Entdecke CME Artikel
Entdecke CME Artikel  Entdecke Artikel mit Download
Entdecke Artikel mit Download 




 Mit Google einloggen
Mit Google einloggen
 Mit Facebook einloggen
Mit Facebook einloggen
Keine Kommentare.