Die komplexe Interaktion zwischen oraler Gesundheit, Stoffwechsel und Entzündungen zeigt sich besonders deutlich bei der Trias Parodontitis, Adipositas und Diabetes mellitus Typ 2. Seit einer japanischen Untersuchung aus dem Jahr 1998 ist bekannt, dass bei Vorliegen einer Adipositas (BMI ≥ 30 kg/m2) das Parodontitisrisiko 3,4- bzw. 8,6-mal höher ist als bei Normalgewicht [37]. Dass Typ-2-Diabetiker häufiger an Parodontitis erkranken, wurde bereits 1993 von Löe beschrieben, der seinerzeit Parodontitis als die sechste diabetische Komplikation bezeichnete [25]. Zahlreiche epidemiologische Studien konnten zwischenzeitlich belegen, dass das Parodontitisrisiko bei Patienten mit Diabetes mellitus Typ 2 im Vergleich zu Nichtdiabetikern 3- bis 4-fach erhöht ist [28,44]. Wodurch sich das Beziehungsgeflecht zwischen Parodontitis, Diabetes mellitus Typ 2 und Adipositas ergibt und welche Ernährungsstrategien daraus abgeleitet werden können, wird nachfolgend erörtert.
Parodontitis: Pathomechanismen und systemische Folgen
Die Parodontitis als chronische entzündliche Erkrankung des Zahnhalteapparats betrifft sowohl die Gingiva als auch das umgebende Knochengewebe [38]. Die Bildung des Biofilms am Zahnfleischrand führt zur Gingivitis, dem Beginn der Entwicklung einer Parodontitis. Ursachen sind neben der für die Parodontitis entscheidenden Dysbiose der oralen Mikrobiota bekanntermaßen auch unzureichende Mundhygiene, genetische Prädisposition, immunologische Defizite, Rauchen, verschiedene Arzneistoffe und eben auch Adipositas und Diabetes mellitus Typ 2.
Die Verschiebung des oralen Milieus zugunsten pathogener Keime, vor allem Pseudomonaden, führt zu einer Immunantwort, in deren Zuge es zur Freisetzung proinflammatorischer Zytokine wie Interferon-γ (IFN-γ), Interleukin-17 (IL-17) und Tumornekrosefaktor-α (TNF-α) kommt. Diese induzieren die Freisetzung von proteolytischen Enzymen, insbesondere Matrix-Metalloproteinasen (MMPs), durch die Immunzellen. Die kombinierte Wirkung von Zytokinen und Enzymen führt letztlich zur Degradation des Parodontalgewebes [15,38]. Für Parodontitis charakteristisch ist der Feedforward-Kreislauf, bei dem sich Dysbiose und Entzündung gegenseitig verstärken. Über lokale Effekte hinaus werden systemische Folgeerkrankungen wie Adipositas und Diabetes mellitus Typ 2 begünstigt [15].
Adipositas: Besonderheiten des viszeralen Fettgewebes
Adipositas ist gekennzeichnet durch eine das physiologische Maß übersteigende Zunahme der Körperfettmasse, wodurch das Risiko für gesundheitliche Beeinträchtigungen und Folgeerkrankungen ansteigt. Für metabolische und mit inflammatorischen Prozessen einhergehende Prozesse ist weniger die absolute Fettmasse von Bedeutung, sondern die Körperfettverteilung. Ein hohes Risiko geht dabei von einer intraabdominalen Fettakkumulation aus. Dieses viszerale Fettgewebe weist es eine hohe Zelldichte und eine gute Ansprechbarkeit auf Adrenalin auf, während die Insulinsensitivität vermindert ist. Hieraus resultiert eine verstärkte Lipolyse und damit eine erhöhte Freisetzung von freien Fettsäuren aus dem Fettgewebe.
In der Folge kommt es zu ektopischen Fetteinlagerungen in Leber, Pankreas und Muskulatur (s.u.). Ab einem noch nicht definierten Schwellenwert reagiert viszerales Fettgewebe zudem mit einer Stressreaktion, die über verschiedene Mechanismen zu einer Inflammation des Gewebes und einer damit einhergehenden Sekretion proinflammatorischer Zytokine führt. Zytokine wie Interleukin-6 (IL-6), TNF-α und C-reaktives Protein (CRP) fördern nicht nur die Entzündungsreaktion im Fettgewebe selbst, sondern auch eine systemische Entzündungsreaktion [13,14]. Die entstehende chronische niedrigschwellige Entzündung (Low-Grade Inflammation; Silent Inflammation) fungiert als ein zentraler prädisponierender Faktor für die Entwicklung von Diabetes mellitus Typ 2. Dies ist selbst bei Normalgewichtigen mit erhöhtem Bauchumfang als Marker der intraabdominalen Fettverteilung gegeben [12].
Diabetes mellitus Typ 2: Bedeutung von Adipositas
Die Mechanismen, über die Adipositas eine Insulinresistenz hervorruft und die Entwicklung von Diabetes mellitus Typ 2 begünstigt, sind vielfältig. Die gesteigerte Produktion von proinflammatorischen Zytokinen hemmt u.a. die Aktivierung von Insulinrezeptor-Substrat-1 (IRS-1) und führt zu einer verminderten Aktivierung des Insulin-vermittelten Signalwegs, was zu einer reduzierten Glukoseaufnahme und -verwertung vor allem in Muskel- und Fettzellen führt. Vermindert ist in dieser Situation hingegen die Sekretion von Adiponektin, einem Mediator, der die Insulinempfindlichkeit der Zellen steigert.
Die verstärkte Freisetzung von Fettsäuren aus dem viszeralen Fettgewebe führt zu verstärkten Fetteinlagerungen in der Muskulatur. Dabei entstehen u.a. Ceramide und Diacylglycerol. Auch diese können die Weiterleitung des Insulinsignals stören. In der Leber kommt es durch die erhöhte Fetteinlagerung zu einem vermehrten Export von Very Low Density Lipoprotein (VLDL) und längerfristig zur Ausbildung einer nichtalkoholischen Fettleber (NALD), aber auch zur Abnahme der Insulinclearance. Die Kombination von vermindertem Insulinabbau und einer als Reaktion auf die Insulinresistenz kompensatorisch erhöhten Insulinsekretion zeigt sich in Form einer Hyperinsulinämie, die bereits vor der Manifestation eines Diabetes mit einer Reihe unerwünschter Begleiteffekte verbunden ist [2,4].
Adipositas und Diabetes mellitus Typ 2: Bedeutung für die Pathogenese der Parodontitis
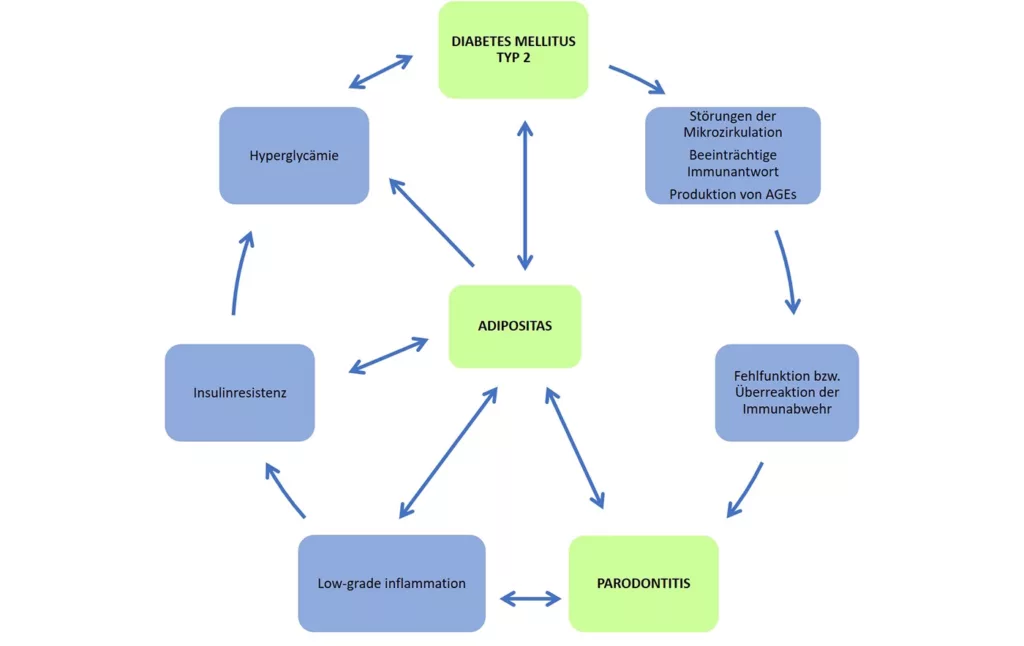
Welche Zusammenhänge sich durch die dargestellten Prozesse zwischen Parodontitis, Adipositas und Diabetes mellitus Typ 2 ergeben, zeigt stark vereinfacht Abbildung 1.
 Hahn/Behrendt
Hahn/BehrendtAdipositas verstärkt bereits ohne Vorliegen eines Diabetes mellitus über eine Low-Grade Inflammation, zunehmende Insulinresistenz und Hyperglykämie das Risiko für parodontale Erkrankungen. Der systemische Entzündungsprozess verstärkt auch das inflammatorische Geschehen am Zahnhalteappararat. Insulinresistenz und Hyperglykämie beeinträchtigen vor allem die zelluläre Immunantwort und verzögern die Wundheilung. Auch ein erhöhter oxidativer Stress durch eine vermehrte Bildung reaktiver Sauerstoffspezies sowie Veränderungen der oralen und intestinalen Mikrobiota tragen zur Progression der Parodontitis bei [22,24,27,36].
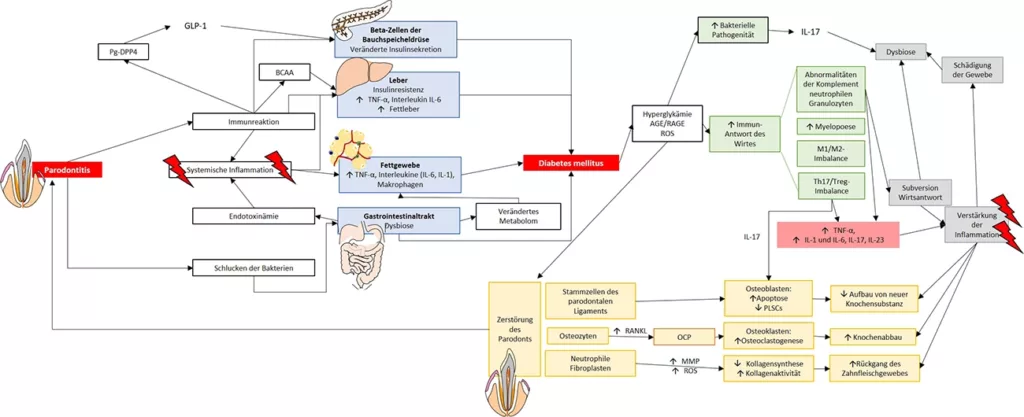
Liegt ein Diabetes mellitus Typ 2 vor, erhöht sich das Risiko für parodontale Erkrankungen weiter [30] (Abb. 2). Neben den skizzierten Mechanismen tragen bei vielen Patientinnen und Patienten weiterhin Hypertonie und Dyslipidämie zu einer ungünstigen metabolischen Gesamtlage bis hin zum metabolischen Syndrom bei. Altersassoziierte Probleme wie reduzierter Speichelfluss und Mundtrockenheit begünstigen das Risiko für Zahnerkrankungen zusätzlich. Hyperglykämien gehen mit einer erhöhten Glykosylierung zellulärer Strukturen einher. Die dabei entstehenden Advanced Glycosilation Endproducts (AGEs) spielen bei Diabetikern eine wesentliche Rolle bei der Entstehung und Progression einer Parodontitis: Sie fördern inflammatorische Prozesse und Gewebeschäden im Parodontalgewebe, indem sie zur Freisetzung proinflammatorischer Zytokine führen und auf diesem Weg Struktur und Funktion von Kollagen beeinträchtigen.
 Hahn/Behrendt
Hahn/BehrendtVermittelt wird dies, indem AGEs die RAGE-Rezeptoren (Receptor for Advanced Glycation End Products) an Gingivazellen stimulieren. Diese Reaktion verstärkt die Freisetzung proinflammatorischer Zytokine wie Interleukin IL-1β, IL-6 und TNF-α und fördert die Entzündung im Parodontalgewebe. Zudem verschlechtern AGEs Wundheilung und Durchblutung des Parodontalgewebes, was dessen Regeneration erschwert und damit die Progression von Parodontitis fördert [2,22,24,27,36]. Langfristig erhöhte Blutglukosespiegel beeinträchtigen außerdem die Durchblutung des Zahnhalteapparates. Hierfür sind einerseits Diabetes-assoziierte Gefäßveränderungen mit einer Minderdurchblutung verantwortlich.
Andererseits führt die Glykosylierung von Hämoglobin dazu, dass dessen Affinität zu Sauerstoff ansteigt. Hierdurch nimmt die Sauerstoffversorgung im Gewebe weiter ab, weil die Sauerstoffabgabe vermindert ist, was Immunabwehr und Regenerationsfähigkeit des Parodonts reduziert. Studien konnten zeigen, dass der glykämische Status bei Diabetikern mit dem Ausmaß der Parodontitis korreliert ist. So war eine Gingivitis bei Patientinnen und Patienten mit unzureichender Blutglukosekontrolle und hohen HbA1c-Werten häufiger zu beobachten als bei guter Stoffwechseleinstellung [2,5].
Bedeutsam sind zudem die Konsequenzen des Diabetes mellitus Typ 2 für die ossären Komponenten des Zahnhalteapparats. Ein chronisch erhöhter Blutzuckerspiegel geht über die Produktion proinflammatorischer Zytokine mit einer Stimulierung von Osteoklasten und einer verstärkten Knochenresorption einher, was die Struktur des Zahnhalteapparats schwächt. Darüber hinaus können AGEs direkt die Osteoklastenaktivität steigern und deren Lebensdauer verlängern. Durch die Dysregulation von Metalloproteinasen (MMPs), die eine entscheidende Rolle im Knochenstoffwechsel einnehmen, wird der Abbau von extrazellulärer Matrix (ECM) sowie Knochengewebe gesteigert und das Remodelling von Knochen und Bindegewebe beeinträchtigt [2]. Viele der dargestellten Auswirkungen ergeben sich durch Hyperglykämien auch bei einem schlecht eingestellten Diabetes mellitus Typ 1 [6].
Parodontitis: Einfluss auf Adipositas sowie Insulinempfindlichkeit und Glukosehomöostase
Umgekehrt nimmt Parodontitis durch den chronischen inflammatorischen Zustand offenbar auch auf die Entstehung von Adipositas Einfluss [19]. Iwashita et al. 2020 [19] zeigten, dass die Verabreichung von Porphyromonas gingivalis, einem Leitkeim von Parodontitis, nachweislich zu weiterer Gewichtszunahme und vermehrtem Fettgewebe bei durch Ernährung fettleibigen Mäusen führte. Darüber hinaus wurde berichtet, dass eine durch Porphyromonas gingivalis hervorgerufene Endotoxämie möglicherweise eine Fettleibigkeit beeinflusst, indem sie die endokrinen Funktionen im braunen Fettgewebe von Mäusen verändert. Welche Bedeutung diesen Mechanismen beim Menschen zukommt, ist noch nicht geklärt. Unstrittig ist hingegen, dass mit der Parodontitis einhergehende Verluste der Kaufähigkeit die Lebensmittelauswahl der Patientinnen und Patienten negativ beeinflussen, was wiederum zu einer Gewichtszunahme und einer Verschlechterung der allgemeinen Gesundheit beiträgt [3,21].
Auch die Beziehung zwischen Parodontitis und Diabetes mellitus Typ 2 ist bidirektional (Abb. 2) [2,9,11]. Parodontitis trägt durch die Entzündungsreaktion im Zahnhalteapparat und die Freisetzung von proinflammatorischen Zytokinen zu einer verminderten Insulinempfindlichkeit in verschiedenen Geweben, einschließlich Leber, Fettgewebe und Muskelgewebe bei, wodurch es zu Störungen der Glukosehomöostase kommt [2]. So zeigte eine 7-jährige prospektiven Studie an 5.848 Nichtdiabetikern im Alter zwischen 30 und 59 Jahren, dass mittelschwere (Taschen: 3,5–5,5mm) und schwere (Taschen > 5,5mm) Formen der Parodontitis signifikant mit einem erhöhten Diabetesrisiko verbunden waren [18].
Bedeutung einer energieadäquaten, antiinflammatorischen Ernährung
Gezielte Ernährungsansätze sind aufgrund der gemeinsamen Ätiologie und der sich ergebenen Wechselwirkungen zwischen den Erkrankungen von großer Bedeutung. Die Ernährung kann dabei auf mehreren Ebenen das pathogenetische Geschehen beeinflussen:
Offenkundig ist die Bedeutung einer energieadäquaten Ernährung. Sie verfolgt bei einer Sicherstellung der Versorgung mit allen Nährstoffen das Ziel, Körpergewicht und Fettmasse zu reduzieren bzw. im Normbereich zu halten [12]. Im Mittelpunkt stehen pflanzliche Lebensmittel wie Obst, Gemüse, Vollkornprodukte, Hülsenfrüchte und Nüsse, ergänzt um Milchprodukte, mageres Fleisch und (fetten) Fisch. Der Konsum von Zucker, gesättigten Fetten und stark verarbeiteten Lebensmittel sollte hingegen vermindert werden. Dies ist nicht nur für die Adipositas- und Diabetesprävention von entscheidender Bedeutung, sondern auch für die Gesunderhaltung des Zahnhalteapparates [22,24,27,36]. Studien weisen darauf hin, dass eine ausgewogene, am Energiebedarf ausgerichtete Ernährungsweise und ausreichend körperliche Aktivität Risiko und Schwere einer Parodontitis reduzieren können [189,45,49].
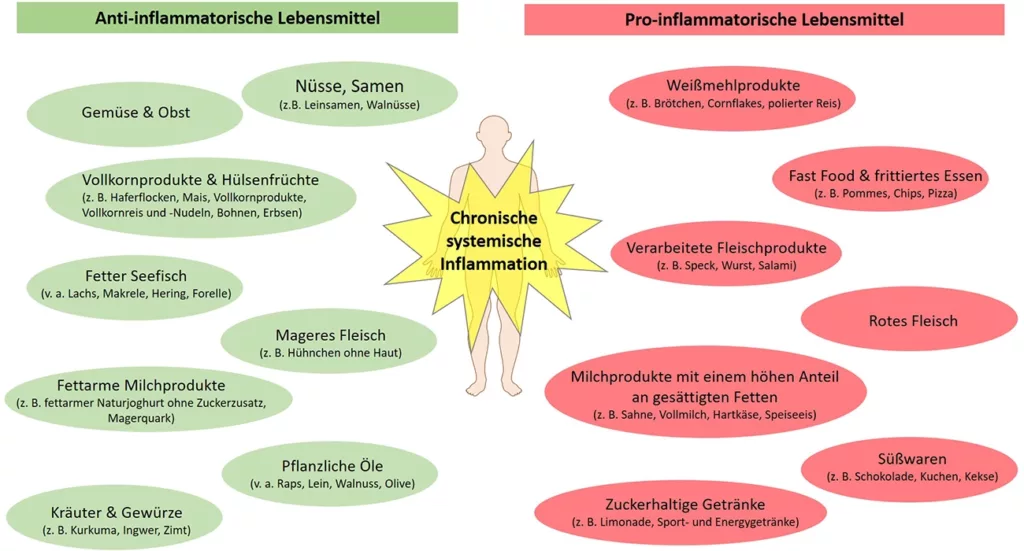
Anzustreben ist gleichzeitig eine Verminderung des inflammatorischen Potenzials der Nahrung (Abb. 3). Eine antiinflammatorische Ernährungsweise zielt darauf ab, Entzündungsprozesse zu modulieren und die Folgen entzündlicher Erkrankungen zu reduzieren [14]. Im Vordergrund steht der Verzehr von vor allem pflanzlichen Lebensmitteln, die eine geringe glykämische Wirkung zeigen, reich an Ballaststoffen, Vitaminen und Mineralstoffen sind und gleichzeitig eine geringe Energiedichte aufweisen. Dies ist bei der skizzierten Lebensmittelauswahl gegeben. Eine typische Western Diet mit hohen Anteilen an Lebensmitteln tierischen Ursprungs, stark verarbeiteten Produkten (mit hohen Mengen an Gesamtfett, gesättigten Fettsäuren und Transfettsäuren) sowie einer erhöhten Zufuhr stark raffinierter Kohlenhydrate wirkt hingegen proinflammatorisch.
 Hahn/Behrendt
Hahn/BehrendtBallaststoffreiche Lebensmittel statt Konsum niedermolekularer Kohlenhydrate
Ein reduzierter Konsum von niedermolekularen Kohlenhydraten ist für die Glukosehomöostase, die Erhaltung des Körpergewichts, die Prävention von dentalem Biofilm und Entzündungen im Mundraum gleichermaßen bedeutsam [1,23]. Metaanalysen belegen, dass Saccharose gingivale Entzündungen auslöst, wobei das inflammatorische Geschehen unabhängig von Veränderungen der Plaquemenge ist [1,17]. Daten der NHANES-Studie (National Health and Nutrition Examination Survey) von ca. 2.500 Parodontitispatientinnen und -patienten zeigten, dass der Zuckerkonsum – unabhängig von sonstigen Risikofaktoren – signifikant mit einer höheren Prävalenz tiefer Zahnfleischtaschen assoziiert war [26,34].
Ballaststoffreiche Lebensmittel fördern einerseits Ausbildung und Erhalt einer günstigen intestinalen Mikrobiota, der eine wichtige Rolle bei der Regulation inflammatorischer Prozesse zukommt. (Dieser Aspekt kann aus Gründen des Umfangs hier nicht vertieft werden.) Strukturell weisen Ballaststoffe eine hohe Vielfalt auf, so dass ein breites Spektrum ballaststoffreicher Lebensmittel Verwendung finden sollte, insbesondere Vollkornprodukte, wie Vollkornbrot, Haferflocken oder ungeschälter Reis, sowie Gemüse, Nüsse und Hülsenfrüchte [12]. Ein erhöhter Verzehr anBallaststoffen korreliert invers mit dem Auftreten parodontaler Entzündungen [26,34]. Ballaststoffe verzögern zudem die intestinale Aufnahme von Glukose, was zu stabileren Blutglukosespiegeln beiträgt [1,23]. Studien zeigen, dass ballaststoffreiche Ernährungsformen zu einer Reduzierung klinischer und biochemischer Marker parodontaler Erkrankungen führen können [43].
Gesunde Fette: Omega-3-Fettsäuren
Wesentlich beeinflusst werden entzündliche Prozesse durch das Fettsäuremuster der Nahrung. Eine hohe Aufnahme an Fleisch- und Wurstwaren geht mit einer hohen Zufuhr der Omega-6-Fettsäure Arachidonsäure einher. Diese wird enzymatisch in proinflammatorische Prostaglandine und Leukotriene umgewandelt und verstärkt damit Entzündungsreaktionen. Die langkettigen Omega-3-Fettsäuren Eicosapentaensäure (EPA) und Docosahexaensäure (DHA), die in fettem Fisch (Lachs, Makrele, Hering, Thunfisch) sowie in einigen Algen in relevanten Mengen enthalten sind, besitzen eine gegenteilige Wirkung. Dies ist zum einen darauf zurückzuführen, dass die hieraus (anstatt aus Arachidonsäure) gebildeten Mediatoren nicht bzw. schwach entzündungsfördernd wirken.
Gleichzeitig ist die Synthese entzündungshemmender Resolvine und Protektine gesteigert, während die Genexpression von Entzündungsmediatoren durch EPA und DHA reprimiert wird. Die jeweiligen pflanzlichen Vorstufen von Arachachidonsäure einerseits und EPA/DHA andererseits werden nur in sehr geringem Umfang in die längerkettigen Derivate umgewandelt. Das bedeutet, dass eine pflanzenreiche Ernährung ein deutlich verringertes inflammatorisches Potenzial besitzt, aber nicht in der Lage ist, für die notwendigen Mengen an EPA und DHA zu sorgen [12].
Ergebnisse der NHANES-Studie zeigen, dass die vermehrte Aufnahme von Omega-3-Fettsäuren über die tägliche Ernährung bei Erwachsenen zu einem geringeren Auftreten von Parodontitis führte [32,33]. Allerdings reicht die derzeitige Studienlage noch nicht aus, um die adjuvante Gabe von EPA/DHA grundsätzlich zu empfehlen [7]. Auch im Zusammenhang mit Diabetes mellitus Typ 2 und Adipositas belegen Studien, dass Omega-3-Fettsäuren zu einer Reduktion proinflammatorischer Zytokine führen und durch Modulation von Entzündungssignalwegen zur Verbesserung der Insulinempfindlichkeit und zur Reduktion von Entzündungsmarkern beitragen [10,20,40].
Antioxidanzien neutralisieren Radikale, reduzieren Entzündungen und Zellschäden
Inflammatorische Prozesse werden von einer vermehrten Synthese von reaktiven Sauerstoff- und Stickstoffspezies (ROS, RNS) begleitet. Diese verstärken das Geschehen unter anderem über die Induktion des redoxsensitiven Transkriptionsfaktors NF-κB, woraus eine erhöhte Bildung von proinflammatorischen Zytokinen resultiert. Bedeutsam sind auch oxidative Schädigungen von Knochenproteinen, insbesondere Kollagen. Dies legt nahe, dass eine antiinflammatorische Ernährung auch reich an Antioxidanzien sein sollte, da diese Radikale neutralisieren sowie Entzündungen und Zellschäden reduzieren könnten.
Tatsächlich zeichnet sich das skizzierte antiinflammatorische Ernährungsmuster auch durch einen hohen Gehalt antioxidativ wirksamer Substanzen, vor allem Polyphenolen aus, die sich insbesondere in Obst und Gemüse (insbesondere Beeren, Orangen, Tomaten, grünem Blattgemüse) finden [12]. Die Evidenz für eine Supplementierung von isolierten Antioxidanzien bei Parodontitis ist allerdings insbesondere mit Blick auf Einzelstoffe insgesamt schlecht. Die Datenlage ist inkonsistent, was auf Unterschiede unter anderem in Dosierung und Dauer der Intervention sowie eine unzureichende Charakterisierung der Studienpopulationen zurückzuführen ist [31,46].
Dietary Inflammatory Index bewertet die Ernährungsweise
Ein Parameter, um die entzündungsfördernden oder entzündungshemmenden Eigenschaften einer Ernährungsweise zu bewerten, ist der Dietary Inflammatory Index (DII). Dieser lässt sich für die jeweilige Lebensmittelzusammenstellung berechnen und basiert auf der Annahme, dass bestimmte Nahrungsmittel und Nährstoffe entweder entzündungsfördernd oder entzündungshemmend sind und somit das Risiko für entzündliche Erkrankungen beeinflussen können. Eine – wenngleich keinesfalls die einzige – Möglichkeit, ein antientzündliches Ernährungsmuster mit niedrigem DII in die Praxis umzusetzen, sind vegetarische Ernährungsformen, wenngleich ihnen, wie dargestellt, EPA und DHA fehlen, sofern nicht Algen verzehrt werden.
Mehrere Studien deuten darauf hin, dass eine Ernährung mit einem höheren DII-Wert das Risiko für Parodontitis [29,35,41], Adipositas [8,39] und Diabetes mellitus Typ 2 [16,48] erhöht. Staufenbiel et al. [42] konnten umgekehrt bereits 2013 nachweisen, dass Vegetarier im Vergleich zu Nichtvegetariern eine bessere parodontale Situation (weniger Entzündungszeichen, weniger parodontale Schäden) aufwiesen. Welchen Anteil hieran die bei den Vegetariern bessere häusliche Zahnpflege hatte, muss allerdings offenbleiben.
Fazit
Die enge Verbindung zwischen Parodontitis, Adipositas und Diabetes mellitus ist durch systemische entzündliche Reaktionen geprägt, die dazu führen, dass sich diese Erkrankungen gegenseitig verstärken. Prävention und adjuvante Ernährungstherapie zielen gleichermaßen auf antiinflammatorische, blutglukosestabilisierende und gewichtsregulierende Maßnahmen ab. Empfehlenswert ist hierzu eine pflanzlich orientierte Kostform mit möglichst gering verarbeiteten Lebensmitteln, wobei die Zufuhr an langkettigen Omega-3-Fettsäuren durch einen erhöhten Verzehr von Fettfisch und/oder Algen(ölen) gesteigert werden sollte.
 Entdecke CME Artikel
Entdecke CME Artikel  Entdecke Artikel mit Download
Entdecke Artikel mit Download 






 Mit Google einloggen
Mit Google einloggen
 Mit Facebook einloggen
Mit Facebook einloggen
Keine Kommentare.