|
Getting your Trinity Audio player ready...
|
Die fortschreitende Digitalisierung erfasst zunehmend auch die Zahnmedizin und Zahntechnik. Mit Künstlicher Intelligenz (KI) etabliert sich dabei eine Technologie, die tief in diagnostische und technische Prozesse eingreift. Während in der radiologischen Bildanalyse bereits vielfach KI-basierte Verfahren eingesetzt werden [1], eröffnen sich auch in der zahntechnischen Planung, Fertigung und Kommunikation neue Möglichkeiten. Diese reichen von sprachgesteuerten Befunddokumentationen über automatisierte Designprozesse bis hin zu simulationsgestützter Qualitätskontrolle mit der FEM.
Technologische Grundlagen
Die Integration von KI in die Zahnmedizin führt zur Veränderung der diagnostischen, präventiven und therapeutischen Prozesse. Die zugrunde liegenden Systeme basieren primär auf Methoden des maschinellen Lernens (ML), wobei verschiedene Lernparadigmen je nach Anwendungsszenario zur Anwendung kommen [9].
Überwachtes Lernen (Supervised Learning)
Die meisten dentalen KI-Anwendungen werden mittels überwachten Lernens trainiert. Dabei werden Algorithmen mit annotierten Datensätzen angelernt – also mit Daten, bei denen die Zielvariable (z.B. die Diagnose) bereits bekannt ist. Beispiele hierfür sind (Abb.1):
- Kariesdiagnostik auf Röntgenbildern: Modelle lernen, kariöse Läsionen auf Bissflügelaufnahmen oder Panoramaschichtbildern zu detektieren. Studien zeigen teils eine vergleichbare Sensitivität wie erfahrene Zahnärzte/-innen [8].
- Vorhersage parodontaler Progression: Mittels strukturierter klinischer Daten (z.B. Sondierungstiefen, Blutungsindizes, Rauchstatus) lassen sich Prognosemodelle trainieren, die Patienten/-innen mit hohem Risiko für weiteren Attachmentverlust oder parodontal bedingten Zahnverlust identifizieren [4,6].
- Detektion von apikalen Läsionen: Auch hier kommen bildgebende Verfahren wie Deep Learning zum Einsatz, um periapikale Läsionen auf digitalen Röntgenbildern automatisiert zu erkennen [10].
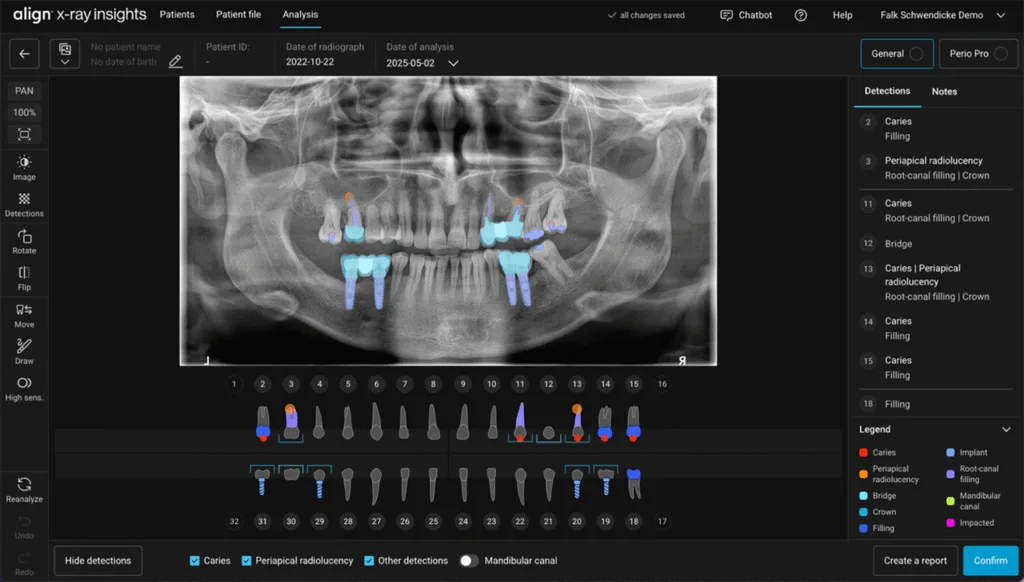 Schwendicke
SchwendickeUnüberwachtes Lernen (Unsupervised Learning)
Unüberwachtes Lernen wird genutzt, wenn keine gelabelten Daten vorliegen. Statt konkrete Zielgrößen zu lernen, erkennen Algorithmen Muster oder Strukturen in den Daten:
- Clusteranalyse in epidemiologischen Datensätzen: Patientenkohorten können hinsichtlich Parodontalstatus, genetischer Marker oder Verhaltensmuster in Subgruppen (Cluster) eingeteilt werden, was neue Klassifikationen und personalisierte Behandlungsansätze ermöglicht.
- Dimensionalitätsreduktion bei genomischen Daten: Verfahren wie PCA oder t-SNE werden eingesetzt, um Hochdimensionalität komplexer biologischer Daten (z.B. Mikrobiomprofile) auf relevante Faktoren zu reduzieren.
Reinforcement, Hybrides und Transfer Learning
Reinforcement Learning spielt bislang eine untergeordnete Rolle in der klinischen Zahnmedizin, könnte aber z.B. in der Robotik und automatisierter Behandlungsplanung, u.a. bei Sequenzentscheidungen, relevant werden. Fortschritte ergeben sich zudem durch hybride KI-Modelle, die verschiedene Lernformen kombinieren (z.B. semi-supervised Learning bei limitiert annotierten Bilddaten). Auch das Transfer Learning gewinnt an Bedeutung: Modelle, die auf großen medizinischen Bilddatensätzen vortrainiert wurden, können mit vergleichsweise kleinen dentalen Datensätzen feinjustiert werden.
CNNs
Technisch dominieren vor allem im Bereich der Bildverarbeitung Convolutional Neural Networks (CNNs). CNNs sind künstliche neuronale Netze, die speziell für die Analyse von Bilddaten entwickelt wurden. Ihr zentrales Merkmal ist die Fähigkeit, visuelle Merkmale wie Kanten, Texturen und Formen durch sogenannte Filter (oder „Kerne“) automatisch zu extrahieren.
Diese Filter durchlaufen das Bild in Form von Convolution-Operationen und erzeugen dabei Feature Maps, die charakteristische Strukturen der Eingabedaten hervorheben. In mehreren hierarchischen Schichten lernen CNNs so zunehmend komplexere Merkmale – von einfachen Kontrasten bis hin zu ganzen anatomischen Strukturen wie Zahnschmelzgrenzen oder kariösen Läsionen [9].
Bekannte CNN-Architekturen wie AlexNet, VGGNet oder Res-Net kommen in zahnmedizinischen Anwendungen beispielsweise zur Erkennung von Parodontalstrukturen oder zur Klassifikation endodontischer Zustände auf Röntgenbildern zum Einsatz, insbesondere bei Bissflügel- und Panoramaaufnahmen.
Allerdings zeigen sich in der Praxis auch typische Limitationen: So kann die Leistungsfähigkeit von CNNs erheblich durch Artefakte in den Bilddaten, fehlerhafte Segmentierung oder unstandardisierte Aufnahmeprotokolle beeinträchtigt werden. Unterschiede in Bildauflösung, Kontrast oder Aufnahmewinkel führen oft zu einer eingeschränkten Generalisierbarkeit. Darüber hinaus besteht das Risiko, dass Modelle, die auf stark selektiven Trainingsdaten basieren, bei neuen oder seltenen Befundkonstellationen versagen. Eine Evaluation an externen Datensätzen ist daher unabdingbar für den erfolgreichen Einsatz von CNNs im klinischen Alltag [5].
Sprachmodelle (NLP)
Sprachmodelle (Natural Language Processing, NLP) stellen eine Unterkategorie der KI dar, die sich mit der Verarbeitung, Erzeugung und Interpretation menschlicher Sprache beschäftigt. Technologisch basieren moderne Sprachmodelle wie GPT (Generative Pre-trained Transformer) oder BERT (Bidirectional Encoder Representations from Transformers) auf sogenannten Transformer-Architekturen. Diese nutzen Mechanismen wie „Self-Attention“, um den Kontext einzelner Wörter oder Satzteile über größere Textzusammenhänge hinweg zu analysieren und zu gewichten [2].
In der Praxis werden solche Modelle zunächst auf großen Korpora von Textdaten vortrainiert (unsupervised pretraining). Hierbei lernen sie grammatikalische Strukturen, Bedeutungszusammenhänge und semantische Muster. Anschließend erfolgt häufig eine Feinabstimmung (fine-tuning) auf spezifische Anwendungsgebiete – etwa zahnmedizinische Terminologie, Befundberichte oder Laborformulare – mithilfe annotierter Daten (supervised learning).
Ein Vorteil dieser Architektur liegt in ihrer Fähigkeit, auch bei komplexen Anfragen kohärente, relevante und oft kontextsensitiv Antworten zu liefern. Sprachmodelle können sowohl Texte generieren (z.B. automatisierte Arztbriefe oder Patienteninformationen), Texte klassifizieren (z.B. automatische Zuweisung von ICD-Codes) als auch dialogisch agieren (z.B. in Form von Chatbots für Terminvergabe oder Rückfragen im Labor).
Ihre Anwendbarkeit in der Zahnmedizin ist daher breit gefächert und reicht von der Vereinfachung administrativer Aufgaben bis zur Erweiterung patientennaher Kommunikation. Dennoch sind auch die Limitationen dieser Systeme zu beachten: Große Sprachmodelle neigen zu sogenannten Halluzinationen, bei denen sie plausible, aber faktisch falsche Inhalte erzeugen.
Zudem fehlt ihnen ein echtes Weltverständnis, da sie auf statistischen Korrelationen in Trainingsdaten beruhen. Dies kann insbesondere bei klinischen Aussagen oder der Interpretation medizinischer Fachbegriffe zu problematischen Ergebnissen führen. Daher ist eine sorgfältige fachliche Prüfung und gegebenenfalls die Ergänzung durch wissensbasierte Systeme oder menschliche Kontrolle zwingend erforderlich. Entscheidend bleibt jedoch die kritische Überprüfung der inhaltlichen Richtigkeit und der Adaptierbarkeit an lokale Gegebenheiten.
Finite-Elemente-Modelle
Die Finite-Elemente-Methode (FEM) stellt ein numerisches Verfahren dar, das physikalische Belastungen und Materialverhalten simuliert. Grundlage der FEM ist das Prinzip der Diskretisierung: Komplexe physikalische Strukturen – etwa eine Krone oder Brückenkonstruktion – werden in eine Vielzahl kleiner, einfach berechenbarer Elemente (z.B. Tetraeder oder Hexaeder) unterteilt. Jedes dieser Elemente besitzt definierte Materialeigenschaften und wird über Knotenpunkte mit den benachbarten Elementen vernetzt. Durch Anwendung der Finite-Elemente-Gleichungen auf jedes einzelne Element und das Zusammenfügen der Teillösungen entsteht ein Gesamtsystem, das die mechanische Reaktion des Objekts unter Belastung abbildet.
Diese Vernetzung ist entscheidend für die Genauigkeit und Relevanz der Simulation, da sie die Übertragung von Kräften und Spannungen realitätsnah modelliert. Sie ist seit Jahren in der biomechanischen Forschung etabliert und findet zunehmend auch Eingang in die klinische Praxis.
In der Zahntechnik wird FEM zur Spannungsanalyse von Kronen, Brücken oder Implantatversorgungen verwendet. Die Kombination von FEM mit KI eröffnet die Möglichkeit, Designparameter zu optimieren und die mechanische Belastbarkeit patientenspezifisch zu simulieren – etwa durch inverse Optimierungsmodelle, die über lernbasierte Verfahren gesteuert werden (Abb. 2).
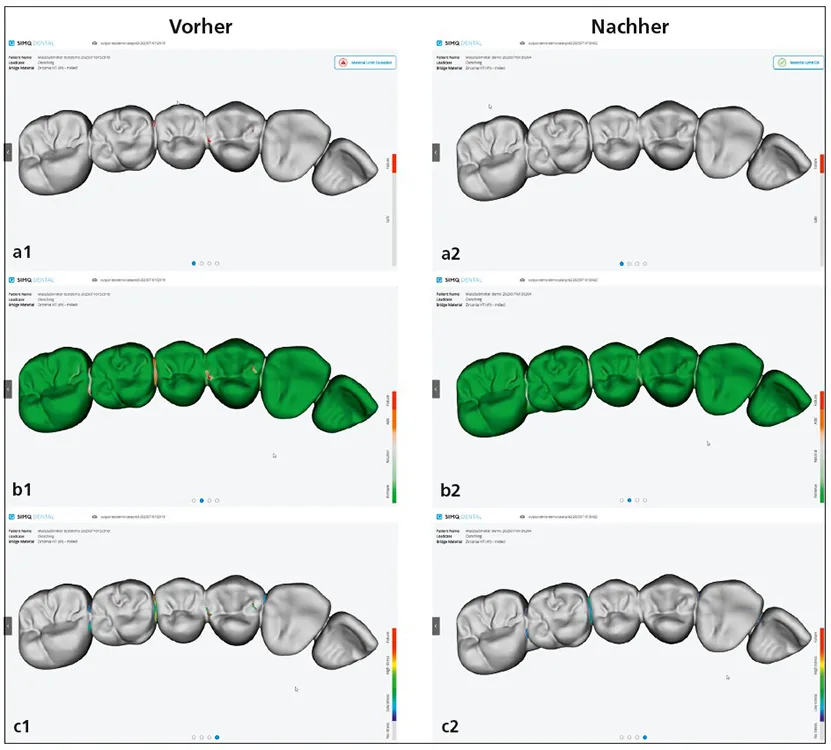 Simq GmbH
Simq GmbHAnwendungsfelder in Klinik und Labor
Die folgenden Beispiele illustrieren die Breite aktueller KI-Anwendungen in der Zahnmedizin und Zahntechnik (Tab. 1). Die Kombination mit FEM ist dabei ein zukunftsweisender Schwerpunkt.
| Anwendungsbereich | Beispiele | FEM-Bezug |
| Bildanalyse | Karies, Parodontitis, apikale Läsionen | nein |
| Sprachverarbeitung | Befundberichte, Chatbots, Sprachsteuerung | nein |
| CAD-Design | Okklusionsoptimierung, Morphologie-Anpassung | ja |
| Fräs-/3D-Druckprüfung | Detektion von Fehlern | teilweise |
| Spannungsanalyse | Suprakonstruktionen, Brücken | ja |
| Designoptimierung | Inverse FEM mit KI-Feedback | ja |
| Planung/Prognose | Recall-Strategien, Zahnverlustprognose | nein |
| Patientenaufklärung | interaktive Dialogsysteme | nein |
Regulatorische Rahmenbedingungen
Die zunehmende Relevanz KI-basierter Systeme in der Zahnmedizin erfordert eine rechtlich-technische Rahmung. Eine zentrale Neuerung ist die ISO-Norm 18374, die erstmals spezifische Anforderungen an KI-Anwendungen in der zahnmedizinischen Bildverarbeitung formuliert. Die Norm legt u.a. fest, dass Trainings- und Validierungsdaten repräsentativ, transparent annotiert und technisch zugänglich sein müssen. Sie fordert zudem die Offenlegung von Modellarchitektur, Schulungsparametern sowie Mechanismen zur Bias-Kontrolle. Dadurch soll ein einheitlicher Qualitätsrahmen geschaffen werden, der Interoperabilität, Nachvollziehbarkeit und Patientensicherheit garantiert.
Ergänzend zur ISO-Norm ist der „EU Artificial Intelligence Act“ von großer Bedeutung [3]. Dieser sieht eine risikobasierte Einteilung von KI-Systemen vor. Anwendungen im medizinischen Bereich gelten dabei als „high-risk“ und unterliegen damit strengeren Zulassungs- und Überwachungspflichten. In Kombination mit der bestehenden Medical Device Regulation (MDR) ergibt sich ein komplexes regulatorisches Umfeld. Besonders herausfordernd ist die Einstufung hybrider Systeme – z.B. FEM-gestützte Entscheidungsunterstützung, die lernende KI-Module integriert.
Ein zentrales Thema regulatorischer Diskussionen betrifft die Generalisierbarkeit von KI-Modellen. Viele aktuell verfügbare Systeme basieren auf begrenzten Trainingsdaten, die aus ausgewählten geografischen Regionen, Alterskohorten oder klinischen Einrichtungen stammen. Dadurch entsteht das Risiko, dass ein System außerhalb dieser engen Rahmenbedingungen nicht verlässlich funktioniert. Modelle müssen daher nicht nur intern, sondern auch extern validiert werden – idealerweise an unabhängigen Datensätzen mit hoher Diversität. Dies betrifft insbesondere auch interethnische Unterschiede, altersbedingte Variabilitäten oder unterschiedliche Bildqualität durch abweichende Scanner oder Bildgebungsgeräte [11].
Auswirkungen auf die Arbeitsrealitäten in Klinik, Zahnarztpraxis und dem zahntechnischen Labor
Die Implementierung von KI-Systemen verändert die Arbeitsrealitäten in zahnmedizinischen Praxen und Kliniken. Wiederkehrende Aufgaben wie die Befundung von Röntgenbildern, Terminvergabe, Abrechnung oder Dokumentation lassen sich durch KI effizienter gestalten. Gleichzeitig ergeben sich tiefgreifende Veränderungen in Arbeitsabläufen, Rollenverteilungen und Kompetenzanforderungen.
In zahnärztlichen Praxen ermöglicht KI eine Entlastung des Praxispersonals bei administrativen Tätigkeiten, etwa durch automatisierte Erstellung von Befundberichten, Spracherkennungssysteme zur Dokumentation oder intelligente Planung von Recall-Intervallen. Auch die Integration von NLP-basierten Systemen kann die Interaktion mit Patienten/-innen verbessern, etwa in Form von Chatbots oder individualisierten Informationsangeboten.
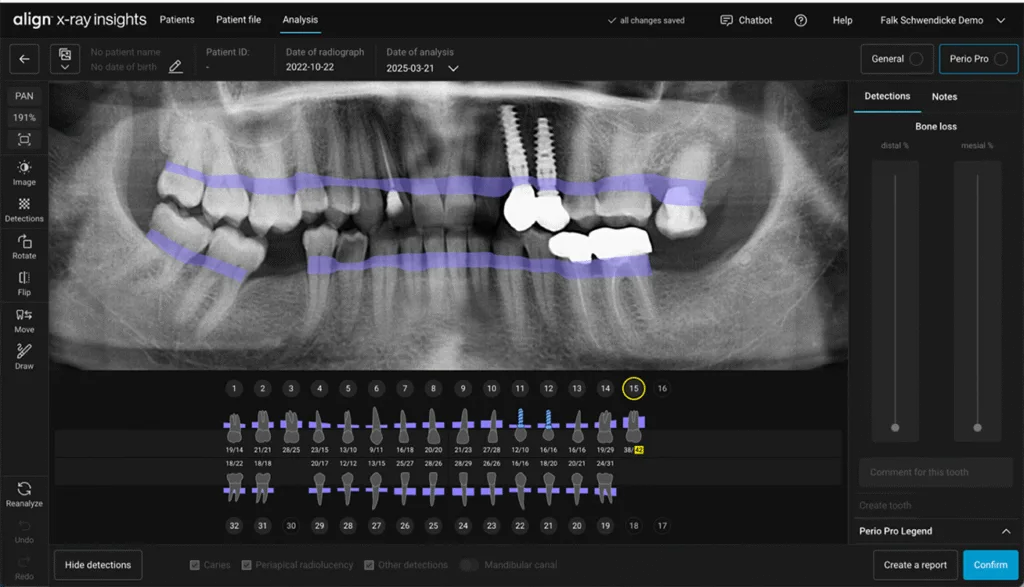 Schwendicke
SchwendickeIn zahnmedizinischen Kliniken kann KI komplexere Versorgungsprozesse strukturieren und die Konsistenz von diagnostischen und Therapieentscheidungen erhöhen, etwa durch prädiktive Analysen zur Risikoabschätzung (z.B. Zahnverlust oder Behandlungsversagen), Bildanalyse-Tools in der Diagnostik (z.B. parodontale Verlaufsbeurteilung, Abb. 3 und 4) oder KI-gestützte Triage in der Notfallversorgung.
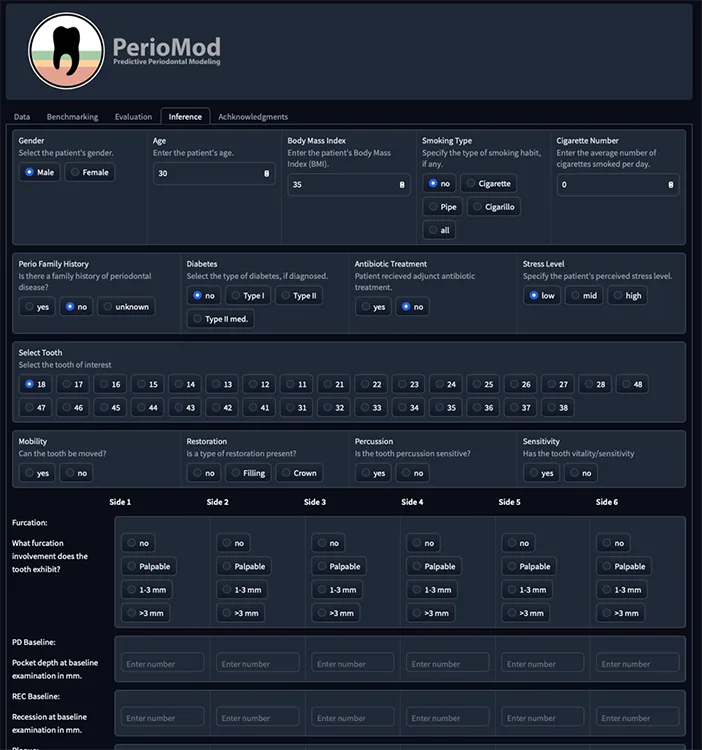 Schwendicke
SchwendickeIn großen Einrichtungen sind zudem interoperable KI-Systeme gefragt, die sich in bestehende Krankenhausinformationssysteme (KIS) integrieren lassen und dabei datenschutzkonform arbeiten. Berufsbilder verändern sich: Zahnärztinnen und Zahnärzte übernehmen vermehrt die Rolle von Supervidierenden, die KI-Ergebnisse kritisch interpretieren und mit klinischer Erfahrung kontextualisieren.
Gleichzeitig entstehen neue Bedarfe in der Aus-, Fort- und Weiterbildung, um ein tiefes Verständnis für die Funktionsweise und Grenzen von KI-Systemen zu entwickeln. Für zahntechnische Labore bleibt die KI eine treibende Kraft für die Automatisierung. Tätigkeiten wie Designprüfung, Fräsdatenkontrolle oder Okklusionsbewertung können KI-gestützt erfolgen. Dabei verschiebt sich die Rolle des Zahntechnikers bzw. der Zahntechnikerin zunehmend hin zu einem/einer digitalen Qualitätsmanager/-in und Supervisor/-in. Gleichzeitig bietet KI auch Chancen für die Integration von Laboren in klinische Workflows – etwa durch cloudbasierte Designprozesse oder gemeinsame Plattformen für digitale Fallplanung.
Organisationale Veränderungen betreffen alle Sektoren: Praxisnetzwerke, Kliniken und Labore müssen sich auf neue Formen der Zusammenarbeit einstellen, bei denen Datenflüsse, Interoperabilität und geteilte Entscheidungskompetenz zentral sind. Dabei gewinnen Fragen der Datensicherheit, Lizenzmodelle, Schnittstellenstandardisierung und rechtlichen Verantwortlichkeit an Bedeutung. Trainingsdaten und Qualitätssicherung sind auch in der klinischen Zahnmedizin kritisch. Unzureichend validierte Modelle können zu Fehlinterpretationen führen – etwa bei Röntgendiagnostik oder Therapieplanung. Daher sind kontinuierliche Evaluierung, externe Validierung und die Einbindung von Nutzerfeedback entscheidend für eine nachhaltige Implementierung.
Ethische und soziale Aspekte
Mit der Einführung von KI-Systemen ergeben sich auch tiefgreifende ethische Fragestellungen. Dazu gehört die Erklärbarkeit (Explainability) von Entscheidungen, insbesondere bei „Black-Box“-Modellen wie tiefen neuronalen Netzwerken. Wenn die technische Begründung für eine Entscheidung – etwa die Auswahl eines Materials oder die Ablehnung eines Designs – nicht nachvollziehbar ist, sinkt das Vertrauen bei Anwendern/-innen und Patienten/-innen [7]. Auch die Verzerrung durch nichtrepräsentative Daten (Bias) kann klinische und wirtschaftliche Risiken bergen.
Wenn z.B. Trainingsdaten nur wenige altersbedingte Zahnmorphologien enthalten, könnten ältere Patienten/-innen systematisch benachteiligt werden. Daher sind Mechanismen zur kontinuierlichen Datenüberprüfung und Bias-Kompensation essenziell. Dazu gehört auch der Einsatz synthetischer Datensätze, die gezielt unterrepräsentierte Gruppen verstärken können [12]. KI-Systeme müssen so gestaltet sein, dass sie faire, diskriminierungsfreie Entscheidungen treffen, unabhängig von Geschlecht, Alter, Herkunft oder sozialem Status.
Nicht zuletzt muss die Frage nach der Haftung geklärt werden: Wer trägt die Verantwortung für ein KI-gestütztes Fehlurteil – der/die Entwickler/-in, das Labor, der/die Zahnarzt/-ärztin? Auch hier ist die Nachvollziehbarkeit von Trainingsdaten und Entscheidungswegen ein zentraler Faktor für Rechtssicherheit und ethische Verantwortbarkeit.
Ausblick und zukünftige Integration
Die nächste Entwicklungsstufe besteht in der Kopplung von KI mit digitalen Zwillingen. Diese virtuellen Repräsentationen individueller Patientensituationen integrieren Bilddaten, Materialparameter, biomechanische Eigenschaften und Krankheitsverläufe. Eine weitere Innovation liegt in cloudbasierten Plattformen, die KI-gestützte CAD-Services, Diagnostik und Qualitätssicherung aus einer Hand anbieten. Hierfür sind standardisierte Schnittstellen, transparente Lizenzmodelle und Datenschutzgarantien erforderlich. Ebenso stellen sich Fragen eines „Lockedin“, also einer zunehmenden Abhängigkeit von einer einzelnen Technologieplattform.
Fazit
KI und FEM transformieren die Zahnmedizin und Zahntechnik grundlegend. Ihr Potenzial liegt nicht nur in Automatisierung, sondern in der datenbasierten Verbesserung von Entscheidungsprozessen, der personalisierten Patientenversorgung und der Absicherung technischer Qualität. Die Herausforderungen – von regulatorischer Unsicherheit über Arbeitsplatzveränderung bis hin zu ethischen Spannungsfeldern – sind erheblich, aber gestaltbar. Entscheidend wird sein, KI nicht als Ersatz, sondern als verantwortungsvolles Assistenzsystem zu begreifen.
 Entdecke CME Artikel
Entdecke CME Artikel  Entdecke Artikel mit Download
Entdecke Artikel mit Download 






 Mit Google einloggen
Mit Google einloggen
 Mit Facebook einloggen
Mit Facebook einloggen
Keine Kommentare.