|
Getting your Trinity Audio player ready...
|
Parodontale Erkrankungen sind multifaktorielle, chronische Krankheiten. Die wesentliche Voraussetzung für Entstehung und Progression einer Parodontitis ist eine (meist) polymikrobielle opportunistische Infektion mit pathogenen Mikroorganismen des oralen Biofilms [1]. Dabei wirken die Bakterien nicht nur direkt; eine entzündliche Reaktion des Parodontiums wird vielmehr auch ohne eine bakterielle Invasion in die entsprechenden Kompartimente des Zahnhalteapparates durch die Immunantwort des Wirts auf den bakteriellen Reiz hervorgerufen [53]. Vor dem Hintergrund dieses pathogenetischen Verständnisses parodontaler Erkrankungen werden in dieser Arbeit nun wissenschaftlich basierte und praxisnahe Empfehlungen für die tägliche Mundhygiene (Abb. 1) herausgearbeitet.
 Walter
Walter Walter
Walter Walter
WalterMikrobielle Ätiologie parodontaler Erkrankungen – von der Plaque zum Biofilm
Die Bedeutung einer Ansammlung oraler Mikroorganismen für die Entstehung entzündlicher parodontaler Erkrankungen wurde lange vermutet und später durch die klassischen 21-Tage Gingivitis-Experimente bewiesen [3,4]. Hier wurde eine unzureichende Mundhygiene durch das Einstellen des Zähneputzens durch die Versuchspersonen simuliert. Die kontinuierliche Akkumulation von Mikroorganismen, mikrobiellen Stoffwechselprodukten, Nahrungsresten und Speichelbestandteilen auf den Zahnoberflächen führte nach einigen Tagen zu einer Veränderung der bakteriellen Zusammensetzung [3,4]. Der Körper selbst reagierte mit einer Entzündungsreaktion – einer Gingivitis. Durch eine Wiederaufnahme der Mundhygiene wurde die Plaque entfernt und die Entzündung klang nach einigen Tagen auch wieder vollständig ab.
Eine Gingivitis ist reversibel. Bestehen der mikrobielle Reiz und die Entzündung nun aber über längere Zeit fort, werden bei einem empfänglichen Organismus tiefere Bestandteile des Parodonts involviert, was schlussendlich zum Abbau des Zahnhalteapparates, das heißt zur Entstehung einer Parodontitis führt [5]. Dieser Prozess ist dann nicht mehr vollständig reversibel. In einer skandinavischen Population konnte gezeigt werden, welchen langfristigen Einfluss mikrobielle Plaque auf den Entzündungsgrad der Gingiva und den folgenden Attachmentverlust an den untersuchten Stellen besitzt [5]. Die klinisch sichtbare Plaqueansammlung an den analysierten Zahnstellen korrelierte mit dem Entzündungsgrad der Gingiva. Darüber hinaus zeigten Zahnstellen, die über den Untersuchungszeitraum von 26 Jahren auf Sondierung geblutet hatten, ca. 70% mehr Attachmentverlust als entzündungsfreie Stellen.
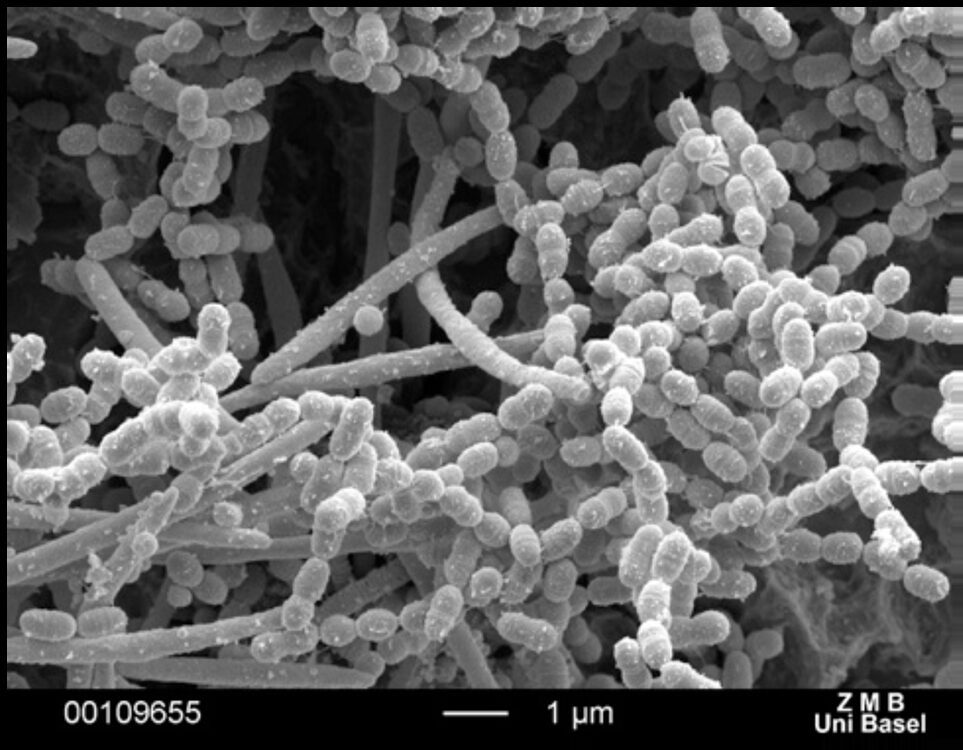
Die oralen Mikroorganismen – es sind nicht nur Bakterien – sind dabei in Form eines Biofilms organisiert [6] (Abb. 2). Diese besondere Struktur schützt unter anderem die Bakterien vor dem wirtseigenen Immunsystem und vor antimikrobiellen Agenzien. In einem Biofilm sind die Mikroorganismen von einer schützenden extrazellulären Matrix aus Exopolysacchariden umgeben. Derartig „eingepackte° Bakterien weisen eine deutlich höhere Widerstandskraft (Resistenz) gegen antimikrobielle Substanzen auf als „frei schwimmende‟ (planktonische) Bakterien [7,8]. Antimikrobielle Wirkstoffe oder auch die Bestandteile des Immunsystems können intakte Biofilme nicht oder nur sehr unzureichend penetrieren [1,10].
 Walter
WalterIn oralen Biofilmen bietet zudem der horizontale Gentransfer den Bakterien ein erhebliches Potenzial zur Anpassung. Es steht die Gesamtheit der genetischen Information der Mikroorganismen des Biotops Mundhöhle, das sogenannte orale Metagenom, potenziell für den Gentransfer zur Verfügung. Dieses Reservoir an Genen ist insofern auch von therapeutischer Relevanz, als dass beispielsweise Virulenz- und Resistenzgene ausgetauscht werden können.
Solche Biofilm-assoziierten Interaktionen sind demnach auch für die Entwicklung neuer antimikrobieller Wirkstoffe von großer Bedeutung und werden daher intensiv erforscht. Dabei zeigte sich, dass in Biofilmen noch ein weiterer Mechanismus eine wichtige Rolle zu spielen scheint. Membranvesikel, die von vielen gramnegativen, aber auch von einigen grampositiven Bakterien freigesetzt werden können, sind ebenfalls in der Lage, unter anderem Nukleinsäuren, Proteine und Polysaccharide innerhalb eines Biofilms zu verbreiten [11]. Ein pathogener oraler Biofilm, wie er z.B. bei Parodontalerkrankungen vorliegt, muss daher mechanisch zerstört werden, um die Mikroorganismen darin überhaupt erreichen zu können [1,2,12–15].
Die mechanische Entfernung und/oder Zerstörung des subgingivalen Biofilms durch eine Dentalhygienikerin oder den Zahnarzt ist daher ein integraler Bestandteil der parodontalen Therapie und damit entscheidende Voraussetzung für den langfristigen Zahnerhalt. In einigen klinischen Situationen und bei bestimmten parodontalen Krankheitsbildern ist es zudem sinnvoll, das Behandlungsergebnis der nichtchirurgischen Therapie durch die zusätzliche Gabe antimikrobieller Wirkstoffe, z.B. in Form systemischer Antibiotika, zu optimieren. Dabei ist darauf zu achten, dass der Einnahmebeginn in engem zeitlichem Zusammenhang mit der mechanischen Zerstörung des Biofilms steht [14,17]. Für eine solitäre Behandlung parodontaler Erkrankungen mit systemischen Antibiotika gibt es keine überzeugende wissenschaftliche Evidenz [14–17].
Aspekte des Biofilmmanagements und der Instrumentierung der erkrankten Parodontien
Wesentliches Ziel der parodontalen Therapie ist die Etablierung eines biologischen Gleichgewichts zwischen dem kontinuierlichen Angriff pathogener Mikroorganismen im parodontalen Sulkus und der Immunantwort des befallenen Organismus [6]. Bis heute gibt es trotz intensiver klinischer und mikrobiologischer Forschung keine wissenschaftlich fundierten Alternativen zur mechanischen Biofilmzerstörung. Daher steht die Entfernung der pathogenen sub- und supragingivalen Biofilme nach wie vor im Fokus der initialen wie auch der darauffolgenden unterstützenden parodontalen Therapie (UPT) in der zahnärztlichen Praxis [15,19]. Bei der initialen Instrumentierung wird neben der Biofilmzerstörung die Etablierung einer biokompatiblen, d.h. einer glatten, harten und dekontaminierten Wurzeloberfläche angestrebt. Verwendung finden daher in erster Linie herkömmliche Handinstrumente wie etwa Gracey-Küretten und/oder Ultraschallgeräte mit speziellen, an die Zahnform adaptierten Spitzen [20].
In der darauffolgenden UPT steht bei stabilen Parodontien (geschlossene parodontale Taschen ohne eine Blutung auf Sondieren und Sondierungstiefen kleiner/gleich 4mm) „nur noch“ die Biofilmzerstörung im Vordergrund [6]. Demzufolge sollte in der UPT minimalinvasiven und zahnhartsubstanzschonenden Verfahren des Biofilmmanagements der Vorzug gegeben werden. Dazu können auch niedrigabrasive Pulverwasserstrahlgemische gewählt werden [18,21,22].
Letztere erzeugen neben verschiedenen anderen Effekten auch hydrodynamische Phänomene wie Kavitationseffekte und Scherkräfte, die zur supra- und subgingivalen Biofilmentfernung beitragen [23]. Sind für die erfolgreiche Umsetzung dieser Therapieschritte der geübte Zahnarzt oder die Zahnärztin mit dem entsprechend aus- und fortgebildeten Personal wie Dentalhygieniker/-in und/oder Prophylaxeassistent/-in verantwortlich, spielen für den Langzeiterfolg vor allem die tägliche und penible Mundhygiene sowie die langfristige Mitarbeit der Patienten/-innen und Compliance mit den zahnärztlichen Empfehlungen die entscheidende Rolle.
Herausforderungen in der individuellen täglichen Mundhygiene
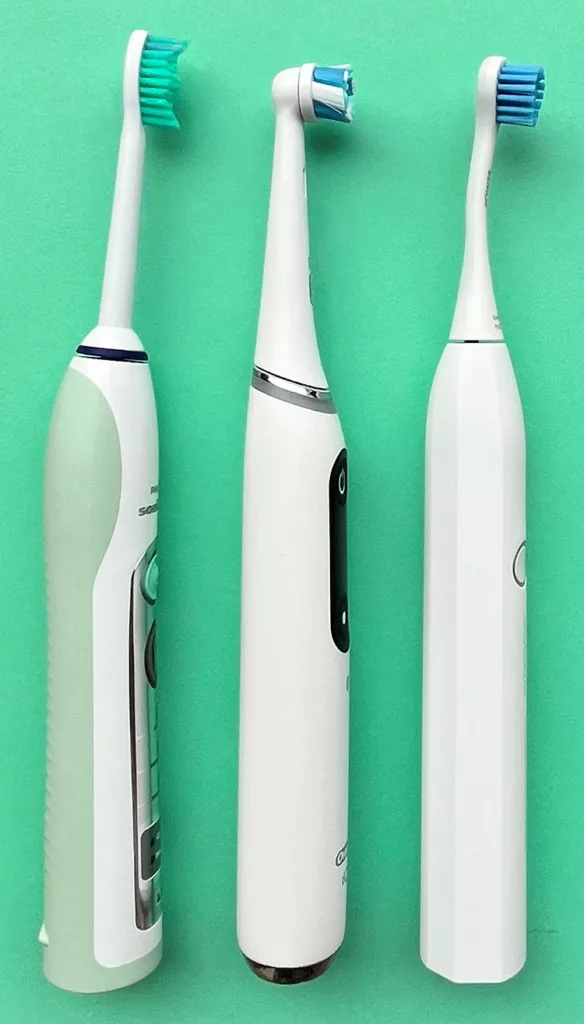
Für die regelmäßige Reinigung der Zähne stehen heute verschiedene Hilfsmittel zur Verfügung (Abb. 1). Darunter finden sich manuelle und elektrische Zahnbürsten, konzipiert in erster Linie für die Säuberung oraler, bukkaler und okklusaler Zahnflächen, sowie Instrumente und Geräte für die Reinigung der Zahnzwischenräume, wie Zahnstocher, Zahnseide, Superfloss, Interdentalraumbürstchen oder auch Mundduschen [20]. Vor allem die Interdentalraumhygiene stellt für viele Patienten/-innen ein Problem dar und Karies sowie Parodontitis etablieren sich daher bevorzugt an den Zahnflächen der Zahnzwischenräume [24–27]. Nur wenige Patienten/-innen zeigen allerdings die manuelle Geschicklichkeit und Compliance, um technisch anspruchsvolle Produkte wie beispielsweise Zahnseide und Interdentalraumbürstchen oder eine entsprechend instruierte Putztechnik auch wirklich vernünftig anzuwenden [28]. Für körperlich oder mental eingeschränkte Patienten kann die adäquate Reinigung der Zähne auch nahezu unmöglich sein.
In einer Reihe von kontrollierten randomisierten klinischen Studien wurde die adäquate Anwendung und Effektivität von Zahnputztechniken sowie die Patientencompliance bei der Verwendung von Zahnseide untersucht. Es wurde gezeigt, dass
- trotz wiederholter Instruktion und Remotivation eine manuelle Zahnputztechnik in den meisten Fällen nicht korrekt durchgeführt wird [29],
- die Verbesserung der Durchführung einer manuellen Zahnputztechnik nicht zu
einer höheren Biofilmreduktion führt [30],
- häufig die gleichen Zahnputztechniken bei manuellen und elektrischen Zahnbürsten angewendet werden [31] und dass
- nur wenige Patienten/-innen Zahnseide benutzen und dies häufig nicht korrekt [32].
Abgesehen davon, dass der zusätzliche Nutzen der Anwendung von Zahnseide wohl mindestens als umstritten anzusehen ist [33]. Vor diesem Hintergrund wäre eine Verbesserung und vor allem Vereinfachung der individuellen Mundhygiene, insbesondere in schwierig zu erreichenden Regionen, für die Prävention parodontaler und anderer oraler Erkrankungen überaus erstrebenswert.
Hand oder elektrische Zahnbürsten?
Elektrische Zahnbürsten stellen durchaus eine Möglichkeit dar, die tägliche Mundhygiene zu vereinfachen. Sie sind seit Jahrzehnten auf dem Markt und wurden kontinuierlich weiterentwickelt, sodass heute zahlreiche Produkte mit unterschiedlichen Wirkmechanismen (und auch Preisklassen) verfügbar sind. Die jeweilige grundlagenorientierte oder klinische Evidenz zur Wirksamkeit der entsprechenden Produkte ist dabei allerdings recht variabel und reicht von „nicht vorhanden“ bis „gut wissenschaftlich abgestützt“ [37–40,44]. Bemerkenswert ist darüber hinaus, dass bislang nur wenige Studien die Langzeitwirksamkeit elektrischer gegenüber manuellen Zahnbürsten auf „harte“ Studienendpunkte wie den Zahnverlust (oder dessen Vermeidung) hin dokumentiert haben.
In diesem Kontext verdient eine Arbeit der Greifswalder Gruppe besondere Beachtung [34]. In dieser Publikation wurden Probanden/-innen bevölkerungsrepräsentativer Studien (Studies of Health in Pomerania, SHIP) über den Zeitraum von elf Jahren mit klinischen Untersuchungen und Interviews systematisch beobachtet. Gesamthaft 2.819 Probanden/-innen mit einem Durchschnittsalter von 52,1 ± 14,4 Jahren wurden dabei statistisch ausgewertet. Die Probanden/-innen, die elektrische Zahnbürsten benutzten (Abb. 1a), waren demnach jünger (46,3 ±12,4 Jahre) als solche, die eine Handzahnbürste (53,4 ± 14,5 Jahre) verwendeten (Abb. 1b). Der Anteil an elektrischen Zahnbürstennutzern/-innen nahm über den Untersuchungszeitraum kontinuierlich von 18,3 auf 36,9% zu. Unter statistischer Berücksichtigung etwaiger Kofaktoren nahmen die durchschnittlichen Sondierungstiefen und der durchschnittliche Attachmentlevel signifikant weniger in der Gruppe der elektrischen Zahnbürstennutzer/-innen verglichen mit Handzahnbürstennutzern/-innen zu. Elektrische Zahnbürstennutzer/-innen hatten, analysiert über die DMFS-Indizes (decayed, filled, missed surfaces) bzw. DFS-Indizes (decayed, filled surfaces), eine geringere Kariesprogression und – das ist von zentraler Bedeutung – elektrische Zahnbürstennutzer/-innen verloren über den Untersuchungszeitraum auch deutlich weniger Zähne.
Hier wurde somit in einer großen Population und über einen beachtlichen Zeitraum von über zehn Jahren herausgearbeitet, dass die Benutzung elektrischer Zahnbürsten offenbar klinisch und aus der Perspektive der Patienten/-innen relevante Vorteile gegenüber Handzahnbürsten aufweist. Dabei steht die Frage im Raum, woran das liegen könnte. Wichtige Aspekte betreffen wohl die einfachere Handhabung, das durch den Kauf einer elektrischen Zahnbürste dokumentierte gestiegene Gesundheitsbewusstsein und damit verbunden wohl auch die Compliance hinsichtlich der Durchführung der täglichen Mundhygiene. Andere Faktoren betreffen möglicherweise aber den Wirkmechanismus bestimmter elektrischer Zahnbürsten.
Hydrodynamische Effekte von Schallzahnbürsten
Von besonderer Bedeutung ist dabei möglicherweise der sogenannte „hydrodynamische Effekt“. Es wird vermutet, dass durch die Aktivität der elektrischen Zahnbürste (Schallzahnbürste) ausgelöste Strömungsphänomene, d.h. insbesondere Scherkräfte, Oberflächenspannungskräfte und akustische Schallwellen, an festen Oberflächen adhärierende Bakterien ablösen und In-vitro-Biofilme zu eliminieren vermögen [35,36]. Das heißt – ganz vereinfacht gesagt – eine quasi zusätzliche Putzwirkung ohne einen direkten Kontakt der Zahnbürstenborsten mit der Zahnoberfläche, eben durch den hydrodynamischen Effekt. In einer Analyse von insgesamt 16 in einer systematischen Übersichtsarbeit eingeschlossenen In-vitro-Studien wurde bereits vor einigen Jahren gezeigt, dass verschiedene Schallzahnbürsten einen Biofilm grundsätzlich auch ohne direkten Borstenkontakt reduzieren können [35]. Die Mehrzahl der Studien konnte eine Biofilmreduktion um mehr als 50% (Schwankungsbreite 38–99%) nachweisen. Es wurden aber auch eine enorme Heterogenität hinsichtlich der Studienparameter und die Notwendigkeit einer Standardisierung des Versuchsdesigns als Herausforderungen künftiger Studien identifiziert.
Konkret sollten die folgenden Eckpunkte berücksichtigt werden:
- Verwendung humanen Speichels für die Pellikelbildung
- Vielfalt der oralen Mikroflora in einem Biofilmmodell
- simulierter kontinuierlicher Speichelfluss in einer Fliesskammer
- Adaptation des Versuchsablaufs an die übliche Zahnputzdauer
- Aufbau einer interdisziplinären Arbeitsgruppe bestehend aus der Klinik für Parodontologie, Endodontologie und Kariologie sowie der Klinik für Präventivzahnmedizin und Orale Mikrobiologie, UZB-Universitätszahnkliniken Basel, sowie dem Department für Physik, Universität Basel, Schweiz
In den letzten Jahren wurde dann in aufeinander aufbauenden Projekten die Wirksamkeit von Schallzahnbürsten auf die In-vitro-Biofilmentfernung ohne direkten Borstenkontakt weiter untersucht. Nach Etablierung und Validierung eines adäquaten Versuchsprotokolls wurden mittlerweile vier In-vitro-Studien durchgeführt [37–41]. Hier soll nun eine kurze Übersicht der daraus gewonnenen Erkenntnisse gegeben werden.
Biofilmmodell und Zahnbürsten
Hier zunächst eine kurze Beschreibung des verwendeten Versuchsdesigns. Die Bildung eines Multispeziesbiofilms erfolgte stets in einem kombiniert dynamischen und statischen Biofilmfilmmodell auf Titanplättchen (SLActive, Straumann AG, Basel, Schweiz), die zuvor in einem Speichel-Serum-Gemisch (Genehmigung Ethikkommission Nr. 295/08) inkubiert wurden. Der In-vitro-Multispeziesbiofilm bestand aus den drei Bakterienspezies Streptococcus sanguinis, Fusobacterium nucleatum und Porphyromonas gingivalis(Abb. 2 und 3).
 Walter
Walter Walter
Walter Walter
Walter Walter
WalterDie ausgewählten Bakterienspezies repräsentieren einigen Untersuchungen zufolge frühe (S. sanguinis) und späte (P. gingivalis) Kolonisierer eines oralen Biofilms [6,42]. Fusobacterium nucleatum wird dabei als sogenanntes Brückenbakterium angesehen, das über Rezeptoren die Verknüpfung zwischen unterschiedlichen Kolonisierern herstellen kann [1,6,43]. Nach Bildung des Multispeziesbiofilms wurde der Einfluss verschiedener zuvor gekaufter Schallzahnbürsten internationaler und nationaler Firmen auf die Biofilmentfernung untersucht. Die Effektivität der Schallzahnbürsten wurde anhand des verbliebenen Biofilmvolumens im Vergleich zu einer unbehandelten Kontrolle analysiert (Abb. 4). Die Quantifizierung erfolgte mittels Fluoreszenzmikroskopie (CLSM, Zeiss LSM700) und der Software Imaris (Bitplane AG, Zürich, Schweiz). Die Ergebnisse wurden statistisch ausgewertet (SPSS® Statistics, SPSS Inc., Chicago, IL, USA).
 Walter
WalterErkenntnisgewinn?
Es konnte zunächst gezeigt werden, dass sich Schallzahnbürsten hinsichtlich ihres Potenzials, einen Multispeziesbiofilm ohne direkten Borstenkontakt zu entfernen, produktspezifisch unterscheiden [37]. Dabei variierte die Biofilmreduktion erheblich (Schwankungsbreite 9–80%). Die Effektivität der Schallzahnbürsten war signifikant unterschiedlich (p < 0,05). Für zwei der untersuchten Schallzahnbürsten konnte eine statistisch signifikante Biofilmreduktion nachgewiesen werden (p = 0,001). In einem nächsten Schritt wurde ein Zahnzwischenraummodell, bestehend aus zwei simulierten benachbarten Zähnen und einem Zahnzwischenraum, für die weiteren Untersuchungen entwickelt (Department für Physik, Universität Basel) [38].
In diesem Modell wurden die Titanplättchen nach Bildung des Multispeziesbiofilms an einer der beiden interdentalen Zahnflächen befestigt. Die Breite des Zahnzwischenraumes betrug 1 mm. Die Borsten der untersuchten Schallzahnbürsten hatten Kontakt zu den simulierten bukkalen Zahnflächen, jedoch nicht zum interdental montierten Biofilm-Titanplättchen. Auch unter diesen modifizierten Bedingungen konnten dreivon vier untersuchten Schallzahnbürsten einen Multispeziesbiofilm ohne direkten Borstenkontakt signifikant reduzieren [38]. Die untersuchten Schallzahnbürsten erzielten eine Biofilmreduktion im Bereich von 7–64%.
Die Effektivität der Schallzahnbürsten war deutlich unterschiedlich (p < 0,05). Eine Übertragung der Ergebnisse auf nicht untersuchte Schallzahnbürsten ist allerdings nicht möglich und sollte vermieden werden. Es gab jedoch Hinweise, dass die Schwingungsfrequenz der Borstenbewegungen eine Rolle bei der Biofilmentfernung spielen könnte. Die Schallzahnbürsten, die eine signifikante Biofilmreduktion erzielen konnten, arbeiteten in einem höheren Frequenzbereich (31000, 42000 und 45000 Bewegungen/min) als diejenige, die keine signifikante Biofilmreduktion erreichen konnte (26000 Bewegungen/min) [29].
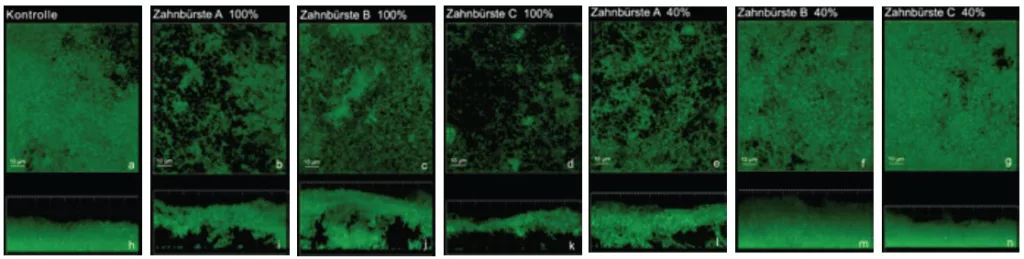
Daher wurde in einer weiteren Untersuchung anhand von Dosisreihen (100, 85, 70, 55 und 40%) der Einfluss der Frequenz der Borstenbewegungen von verschiedenen Schallzahnbürsten (A, B und C) auf eine Biofilmentfernung ohne direkten Borstenkontakt analysiert [39]. Dazu wurden zunächst die Frequenzen (in Hertz) der untersuchten Schallzahnbürsten in den Grundeinstellungen im Physiklabor ermittelt. Ausgehend von der jeweils gemessenen Frequenz (= 100%) wurde die Frequenz anschließend bei jeder Zahnbürste schrittweise reduziert (bis auf 40% der jeweiligen Ausgangsfrequenz). Gleichzeitig wurde die Amplitude (Auslenkung des Borstenkopfes, gemessen in mm) konstant gehalten.
Im Vergleich zu einer Schwingungsfrequenz von 100% erzielten die untersuchten Schallzahnbürsten bei tieferen Frequenzen (bis 40%) eine geringere Biofilmreduktion (mediane Biofilmreduktion bis zu 53% bei einer Frequenz von 100%, und bis zu 13% bei einer Frequenz von 40%) (p ≥ 0,03) [30]. Ferner trat bei tieferen Frequenzen eine erhöhte Variabilität hinsichtlich der Biofilmreduktion auf, d.h., die Biofilmreduktion war weniger vorhersagbar.
Zur Untersuchung der Amplitude des Borstenkopfes der Schallzahnbürsten (A, B und C) anhand von Dosisreihen wurden die Amplituden, die jeweils bei maximaler Frequenz (100%) vorlagen, schrittweise von 100 auf 40% des Ausgangswertes (in mm) reduziert [40]. Gleichzeitig wurde die Frequenz konstant gehalten. Auch bei der Untersuchung der Amplitude variierte die Vorhersagbarkeit der Biofilmreduktion unter den untersuchten Schallzahnbürsten.
Im Vergleich zu den Zahnbürsten A und B zeigte Zahnbürste C eine geringere Variabilität hinsichtlich der Biofilmreduktion. Zahnbürste C erzielte die höchste Biofilmreduktion bei einer Amplitude von 85% (Biofilmreduktion 76%). Die Reduktion der Amplitude von 85 auf 40% führte zu einer geringeren Biofilmreduktion (p = 0,029). Bei einer Amplitude von 85% unterschieden sich die Zahnbürsten C-A (p = 0,029) und C-B (p = 0,029) signifikant hinsichtlich ihrer Effektivität.
 Walter
WalterAusblick auf zukünftige Entwicklungen von Hilfsmitteln zur täglichen Mundhygiene
Die Digitalisierung hat mittlerweile viele, wenn nicht nahezu alle Lebensbereiche erreicht. Im täglichen Leben spielt vor allem das Smartphone – ein multifunktionaler Kleincomputer – eine immer größere Rolle. Auf vielen dieser Geräte sind bereits heute verschiedene Applikationen installiert, die im Umfeld der mobilen Gesundheitsfürsorge einzugruppieren sind. Bekannt sind hier vor allem Werkzeuge zur Überwachung physiologischer Parameter zur Herz-Kreislauf-Kontrolle oder Programme, die sportliche Aktivitäten unterstützen und Trainingserfolge dokumentieren (Abb. 5). Allerdings muss auch festgehalten werden, dass nur wenige dieser Anwendungen tatsächliche ernstzunehmende klinische Prüfungen oder andere Formen einer Qualitätssicherung durchlaufen haben [54]. Auch für den Bereich Mundhygiene und Prophylaxe stehen digitale Hilfsmittel und Anwendungen zur Verfügung [55,56].
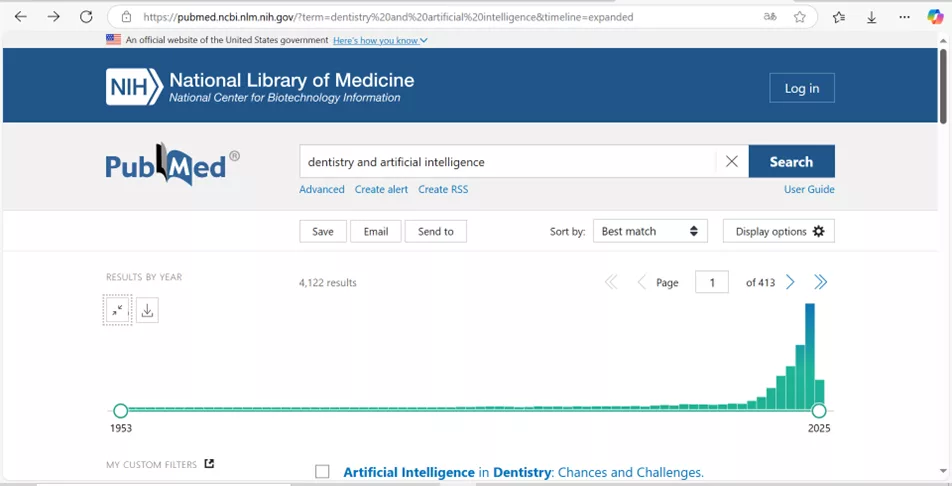
Das Themengebiet zu den Möglichkeiten der Nutzung künstlicher Intelligenz (KI) in der Zahnmedizin steht noch am Anfang. Der rasante Anstieg an Publikationen in den letzten Jahren macht aber eindrücklich das zunehmende wissenschaftliche Interesse und wohl auch die Erwartungen diesbezüglich deutlich (Abb. 6). Eine aktuelle chinesische Studie unter Federführung von Prof. M. Tonettis hat auch heute noch ein Alleinstellungsmerkmal [57]. Die Arbeit gibt interessante Hinweise und zeigt die enormen Potenziale zukünftiger KI-basierter Entwicklungen auf. Im Rahmen einer randomisierten klinischen Studie wurden 100 Parodontitispatienten (Parodontitis-Stadium 2 und 3, entsprechend der aktuellen Klassifikation [58–60] behandelt.
 Walter
WalterIn der Kontrollgruppe wurde die derzeit übliche parodontale Behandlung der Stufen 1 und 2 [61,62], bestehend aus supra- und subgingivaler Instrumentierung und Mundhygieneinstruktion zur Verwendung von Handzahnbürste und Interdentalraumbürstchen, vorgenommen und nach 1 und 3 Wochen wiederholt. Die Testgruppe wurde ebenso behandelt, erhielt aber eine neuartige auf künstlicher Intelligenz basierende multimodale elektrische Zahnbürste, die in Echtzeit den Zahnputzvorgang auch mit Hilfe eines integrierten Gyroskopes erfasst und hinsichtlich der Parameter Putzdruck, Putzzeit/Region sowie Position im Mund erfasst. Über Bluetooth werden die Daten zunächst auf das Smartphone des anwendenden Patienten zur weiteren Analyse via App übertragen. Regionen, die nicht adäquat geputzt waren, wurden daraufhin grafisch auf dem Smartphone dargestellt.
Vom Smartphone erfolgte zudem eine anonymisierte Übertragung der o.g. Parameter sowie der Tageszeit, der Putzdauer und der Antwort auf die Frage nach der Verwendung von Interdentalraumbürstchen via Cloud auf einen ärztlichen Computer. Dadurch wurde eine zusätzliche Fernüberwachung und -führung des Patienten über SMS ermöglicht. Der wichtigste ausgewertete Parameter (primärer Endpunkt) war – klinisch ausgesprochen relevant – die Anzahl entzündeter parodontaler Taschen (Sondierungstiefen ≥ 4 mm mit Bluten auf Sondieren) 6 Monate nach den Interventionen. Fünf Patienten, davon 2 in der Test- und 3 in der Kontrollgruppe, standen nicht für die finale Analyse zur Verfügung.
Die durchschnittliche Anzahl der Feedback-SMS zum konkreten Zahnputzvorgang nahm über den Studienzeitraum kontinuierlich ab. Das bedeutet, dass die Testpersonen mit Hilfe der digitalen Führung relativ schnell lernten, optimal zu putzen und alle Regionen ausreichend lange zu reinigen. Die Anzahl entzündeter Taschen verringerte sich in der Kontrollgruppe von 80,7% auf 52,3% und in der Testgruppe von 81,4% auf 44,4%. Der Unterschied zwischen beiden Gruppen war hinsichtlich des primären Endpunktes statistisch signifikant und betrug 7,9%. Diese Verbesserungen und die Unterschiede zwischen den Gruppen korrespondierten mit den beobachteten Veränderungen bezüglich der Detektion supragingivaler Beläge und des parodontalen Entzündungszustandes sowie mit der mundbezogenen Lebensqualität.
Zusammenfassung und Diskussion
Gingivitis und Parodontitis sind sehr weit verbreitete biofilmassoziierte Erkrankungen [45,46]. Es ist mittlerweile weitgehend akzeptiert und durch eine beeindruckende wissenschaftliche Beweislage auch gut dokumentiert, dass parodontale Erkrankungen mit verschiedenen allgemeinmedizinischen Krankheitsbildern assoziiert sind [63–65]. Oft handelt es sich dabei auch um bidirektionale Beziehungen, das heißt, die erfolgreiche Therapie der einen Erkrankung wirkt sich auch positiv auf die andere Erkrankung aus und umgekehrt. Gut belegt und in der aktuellen Klassifikation bereits integriert ist dabei die Beziehung zwischen Diabetes mellitus und Parodontitis [58–60, 65]. Biofilme sind mitunter schwierig zu adressierende therapeutische Herausforderungen [1].
Von zentraler Bedeutung für die Prävention und die Behandlung parodontaler Erkrankungen ist daher die regelmäßige, individuell-häusliche und gegebenenfalls regelmäßige professionelle Zerstörung der pathogenen Biofilme. Für die persönliche Zahnpflege stehen zwar verschiedene Hilfsmittel zur Verfügung, oft mangelt es aber an der kontinuierlichen Umsetzung einer eventuell ja sogar zuvor instruierten Putztechnik. Die Möglichkeiten, diese Lücke zu schließen, wurden eindrucksvoll durch eine kürzlich publizierte klinische Studie dokumentiert [57]. Die Studie zeigt eine Überlegenheit eines mit künstlicher Intelligenz unterstützten Monitorings und Feedbacks des täglichen Zähneputzens mit einer hochmodernen elektrischen Zahnbürste gegenüber dem traditionellen Vorgehen mit einer Handzahnbürste im Rahmen einer systematischen zeitgemäßen Parodontitistherapie. Das bedeutet hier, dass weiterführende parodontale Therapien – zumeist handelt es sich dabei um parodontalchirurgische Interventionen –, die bei persistierenden erhöhten Sondierungstiefen indiziert sind, bei Anwendung der digital unterstützten täglichen Mundhygiene deutlich weniger vorgenommen werden müssen.
Große epidemiologische Studien über lange Beobachtungszeiträume zeigen eindrucksvoll das enorme Potenzial elektrischer Zahnbürsten bezüglich verbesserter parodontologischer Parameter wie Sondierungstiefen und Attachmentverlust und der Vermeidung von Zahnverlust [34]. Es ist leider nicht bekannt, welche Zahnbürsten konkret von den Studienprobanden verwendet wurden. Unabhängig davon zeigen systematische, aufeinander aufbauende In-vitro-Untersuchungen eine Biofilmentfernung ohne direkten mechanischen Borstenkontakt bestimmter Schallzahnbürsten [35,37–41]. Insbesondere die Frequenz der Borstenbewegungen sowie die Amplitude des Borstenkopfes scheinen die Biofilmreduktion ohne direkten Borstenkontakt zu beeinflussten [40,41].
Die genauen physikalischen Mechanismen, mit denen verschiedene Schallzahnbürsten eine Biofilmreduktion ohne mechanischen Borstenkontakt erzielen können, sind bislang unklar. Die Borsten von Schallzahnbürsten bewegen sich mit einer hohen Geschwindigkeit und können dadurch möglicherweise eine turbulente Bewegung von Flüssigkeiten und/oder von eingeschlossenen Luftbläschen verursachen [47]. Daraus könnten hydrodynamische und thermodynamische Kräfte sowie Schallwellen resultieren, die auf einen Biofilm einwirken und Energie übertragen könnten [48–51]. Ist die übertragene Energie ausreichend, um die adhäsiven Kräfte innerhalb eines Biofilms und/oder die kohäsiven Kräfte zwischen Biofilm und Substrat zu überwinden, kommt es zu einer Ablösung des gesamten Biofilms oder einzelner biofilmassoziierter Bakterien [47]. Die vorliegenden In-vitro-Untersuchungen haben nun gezeigt, dass insbesondere die Schwingungsfrequenz eine Rolle bei der Biofilmreduktion spielt [39]. Eine hohe Schwingungsfrequenz der Borstenbewegungen führt möglicherweise zu mehr Turbulenzen und Luftbläschen in einer Flüssigkeit und somit zu einer anderen Energieübertragung als eine niedrige Schwingungsfrequenz.
Der intraorale Biofilm, der sich in vivo als Plaque auf den Zähnen bildet, kann aus mehr als 700 Bakterienspezies bestehen [52]. Diese bakterielle Vielfalt und die entsprechenden speziesübergreifenden Kommunikationen lassen sich in Laboruntersuchungen bisher nicht wirklich nachahmen. Der Multispeziesbiofilm der vorliegenden In-vitro-Untersuchungen bestand aus den Bakterienspezies S. sanguinis, F. nucleatum und P. gingivalis, die üblicherweise in reifer supragingivaler Plaque sowie bei Patienten/-innen mit fortgeschrittener Parodontitis nachweisbar sind [6]. Inwiefern undob die bakterielle Zusammensetzung eines Biofilms möglicherweise auch die Biofilmreduktion durch Schallzahnbürsten beeinflusst, wurde bisher nicht untersucht.
Klinische Schlussfolgerungen und Empfehlungen
Robuste Evidenz aus aktuellen großen bevölkerungsbasierten Studien zeigt eine Überlegenheit der Effektivität elektrischer Zahnbürsten gegenüber Handzahnbürsten. Darüber hinaus legen systematische Übersichtsarbeiten und In-vitro-Studien einen zusätzlichen Effekt – die Putzwirkung auch ohne direkten Borstenkontakt durch unterschiedliche Strömungsphänomene – bestimmter elektrischer Zahnbürsten (Schallzahnbürsten) nahe. Laboruntersuchungen zeigen aber auch große Unterschiede der untersuchten Zahnbürsten hinsichtlich der Effektivität der Biofilmreduktion. Das bedeutet, dass in der Klinik (Abb. 7–9) in aller Regel eine Empfehlung für elektrische Zahnbürsten und (!) geeignete Hilfsmittel für die Zahnzwischenraumpflege vorliegen sollte.
 Walter
Walter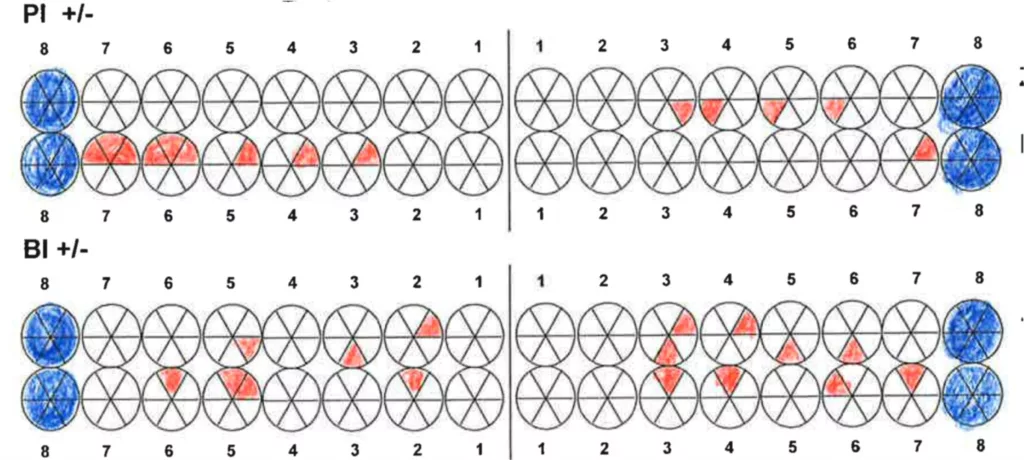 Walter
WalterIdealerweise handelt es sich dabei um Produkte, bei denen in entsprechenden unabhängigen Untersuchungen eine überzeugende Effektivität nachgewiesen wurde. Der Beweis des klinischen Nutzens, insbesondere auch der bezüglich der Wirksamkeit von Zahnbürsten, ist oft schwer zu führen. Aussagefähige klinische Studien – das sind in der Regel teure und aufwändige randomisierte klinische Studien (RCTs), die eine entsprechend hohe Fallzahl und einen eher längeren Untersuchungszeitraum aufweisen – sind selten. Ähnlich verhält es sich mit digitalen Anwendungen im Bereich Medizin (eHealth/ mHealth/ dHealth) [54].
Eine erste klinische Studie höheren Evidenzgrades hat hier beide Graubereiche gleichzeitig aufgehellt und die Frage der Effektivität KI-unterstützter Zahnputzvorgänge mit einem klinisch relevanten Ergebnis unter den definierten Studienbedingungen beantwortet [57]. Es wird interessant sein, zu beobachten, inwiefern sich diese wegweisenden Ergebnisse auch in anderen klinischen Settings und variierenden Populationen bestätigen lassen. Wohl eher nicht auszuschließen ist aber, dass das Smartphone – der multifunktionale Kleincomputer – auch in diesem Bereich des täglichen Lebens einen festen Platz bekommen wird.
Anmerkung
Die Autoren haben keinen Interessenkonflikt. Die Forschung zum hydrodynamischen Effekt von Schallzahnbürsten wurde zum Teil durch den Forschungsfond der Schweizerischen Zahnärzte-Gesellschaft SSO (264-12), den Forschungsfonds der Universität Basel (DZM 2051) sowie den DGPZM-CP GABA-Wissenschaftsfonds finanziell unterstützt [37–40]. Die Titanplättchen wurden von Straumann AG (Basel, Schweiz) zur Verfügung gestellt.
Das vorliegende Manuskript stellt eine zusammenfassende Aktualisierung der folgenden Publikationen dar:
- Schmidt JC, Walter C. Putzen, ohne zu putzen? Hydrodynamische Effekte von Schallzahnbürsten. Parodontologie 2014; 25 (1): 23–29
- Schmidt JC, Zaugg C, Weiger R, Walter C. Brushing without brushing? – A review of the efficacy of powered toothbrushes in noncontact biofilm removal. Clin Oral Invest. 2013; 17: 687–709
- Schmidt JC, Astasov-Frauenhoffer M, Hauser-Gerspach I, Schmidt JP, Waltimo T, Weiger R, Walter C. Efficacy of various side-to-side toothbrushes for noncontact biofilm removal. Clin Oral Invest. 2014; 18: 793–800
- Schmidt JC, Astasov-Frauenhoffer M, Waltimo T, Weiger R, Walter C. Efficacy of various side-to-side toothbrushes and impact of brushing parameters on noncontact biofilm removal in an interdental space model. Clin Oral Invest. 2017; 21: 1565–1577
- Schmidt J, Astasov-Frauenhoffer M, Hauser-Gerspach, I, Waltimo T Weiger R, Walter C. Influence of the oscillation frequency of different side-to-side toothbrushes on noncontact biofilm removal. Clin Oral Invest. 2018; 22: 2141–2147
- Schmidt JC, Walter C. Putzen, ohne zu putzen? – Hydrodynamische Effekte von Schallzahnbürsten. Ein Update. Parodontologie 2019; 117: 153–169
- Schmidt J, Astasov-Frauenhoffer M, Hauser-Gerspach I, Waltimo T, Weiger R, Walter C. Influence of the amplitude of different side-to-side toothbrushes on noncontact biofilm removal. Clin Oral Investig. 2019; 23: 1951–1957
- Walter C, Difloe-Geisert JC. Manuell oder elektrisch putzen – was sagt die Forschung? Bayerisches Zahnärzteblatt (BZB). 2024; Juni: 50-57
 Entdecke CME Artikel
Entdecke CME Artikel  Entdecke Artikel mit Download
Entdecke Artikel mit Download 






 Mit Google einloggen
Mit Google einloggen
 Mit Facebook einloggen
Mit Facebook einloggen
Keine Kommentare.